miRNA-375在肝癌患者血清表达和疗效评估的研究价值
摘 要:目的 全面研究mi RNA-375在肝癌患者血清之中的具体含量,并分析其表达情况和临床的疗效评估参考价值。方法 选择该院2019年2—9月40例前来治疗的肝癌患者为观察组,同时选择同期40例来该院前来治疗的肝硬化等肝部疾病患者设置为对照组,mi RNA使用芯片进行检测,确定出肝癌与良性肝脏肿瘤之中mi RNA的表达差异,使用荧光测量方式对肝脏肿瘤检测。结果 mi RNA-375在观察组患者的血清和血液组织之中的表达量较高,其中,对照组患者的表达量是0.656(2-ΔC1),观察组是2.987(2-ΔC1),两组之间对比差异有统计学意义(t=5.898,P<0.001),发现血清之中的mi RNA-375表达水平高低与患者的TMN分期,癌组织分化有关联,差异有统计学意义(P<0.05)。mi RNA-375的含量和表达水平高低与患者的年龄和性别之间差异无统计学意义(P>0.05)。结论 mi RNA-375在肝癌患者的血清中表达含量增加,可以进行肝癌的疾病预后评判指标。
关键词:miRNA 肝癌 血清 研究价值
肝癌是常见的恶性肿瘤之一,其致死率较高,在所有的癌症之中致死率排名第三。肝癌患者的早期症状没有特异性[1],很多患者在发现或者出现症状之后已经是晚期,该疾病的复发率相对较高,即使进行手术,也常会复发,患者5年之内的存活率较低。临床对于肝癌的研究一直都是热点,研究肝脏的肿瘤标志物对证实肝癌有着重要的作用[2],现有的临床研究之中,mi-RNA的的异常数量表达往往标志患者体内的肿瘤生长,但是研究中缺乏对mi RNA-375的有效研究,缺乏对其与肝癌关系的分析,该文即选取该院2019年2—9月治疗的40例肝癌患者为研究对象,探讨mi RNA-375在肝癌患者血清中的表达,以判别其对肝癌患者预后的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
选择该院40例前来治疗的肝癌患者,设置为观察组,同时选择同期40例来该院前来治疗的肝硬化等肝部疾病患者设置为对照组。观察组患者中,男性共计26例,女性共计14例;年龄为40~77岁,平均年龄为58±4.7岁。对照组患者中,男性共计25例,女性共计15例;年龄为41~79岁,平均年龄为59±5.1岁。以上两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性。该次研究经过医院的伦理委员会批准,患者全部知情同意。
1.2 方法
1.2.1 试剂选择
选择mi RNA3芯片,产自美国,使用mi RNA提取试剂盒,肝癌荧光定量检测试剂盒,产自大连,mi RNA-375及其内参引物。
1.2.2 实验方法
首先进行患者血清标本的提取和保存,首先采集患者与健康对照组人员的静脉血液共计3~5 m L,以上所有血液标本中,筛选出非黄疸和溶血性血液的标本[3],在常温的环境之下进行静置处理,在30 min之后,进行血清的离心处理,使用3 000r/min的离心机器进行长达20 min的离心处理,确保析出上清液后,放入RNA酶之中的-100℃超低温冰箱中进行保存处理[4]。其次进行RNA的提取处理,将血清标本从超低温冰箱中取出之后,迅速放入常温水中进行解冻处理,以上的血清提取量完全依照RNA的提取试剂盒说明进行,确保ENA保存于无RNA酶的EP管之中后,立刻进行PCR的逆转录处理[5]。根据逆转录的说明要求进行逆转录操作,但是mi RNA的分子长度较短,可以使用加尾的方式进行转录处理,在无RNA酶的EP管中进行PCR的逆转录。根据荧光检测试剂盒的相关要求,进行荧光检测,在90℃的环境下进行检测处理,反复循环,在50次循环后进行荧光信号采集,采集重复3次之后取平均数值为最终结果。最终记录患者血液中mi RNA-375的基因表达量[6]。
1.3 统计方法
采用SPSS 20.0统计学软件进行数据分析,计量资料用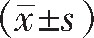 表示,行t检验;计数资料用频数和百分比(%)表示,行χ2检验,P<0.05为差异有统计学意义。
表示,行t检验;计数资料用频数和百分比(%)表示,行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者体内mi RNA的表达情况对比
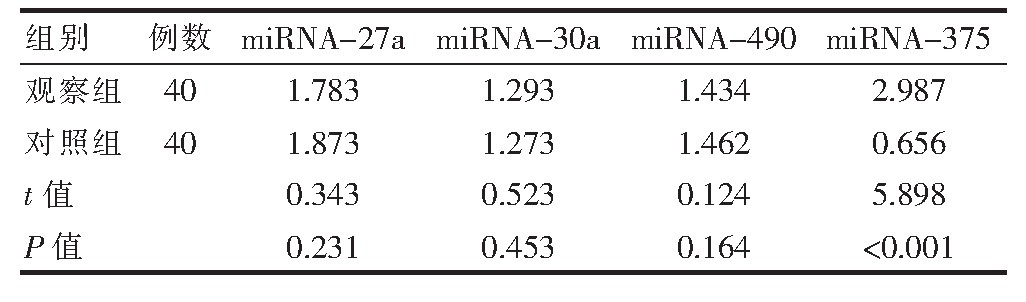
观察组患者血清中mi RNA不同基因表达谱存在一定差异,对比对照组患者体内的mi RNA情况,共计35个mi RNA基因变化显着,其中,mi RNA-27a、mi R-NA-30a、mi RNA-490基因在两组之间差异无统计学意义(P>0.05)。mi RNA-375含量变化情况较为显着,基因在两组之间差异有统计学意义(P<0.05),见表1。
表1 两组患者体内的mi RNA表达情况对比(2-ΔC1)
2.2 观察组患者血清中的mi RNA表达水平影响因素分析
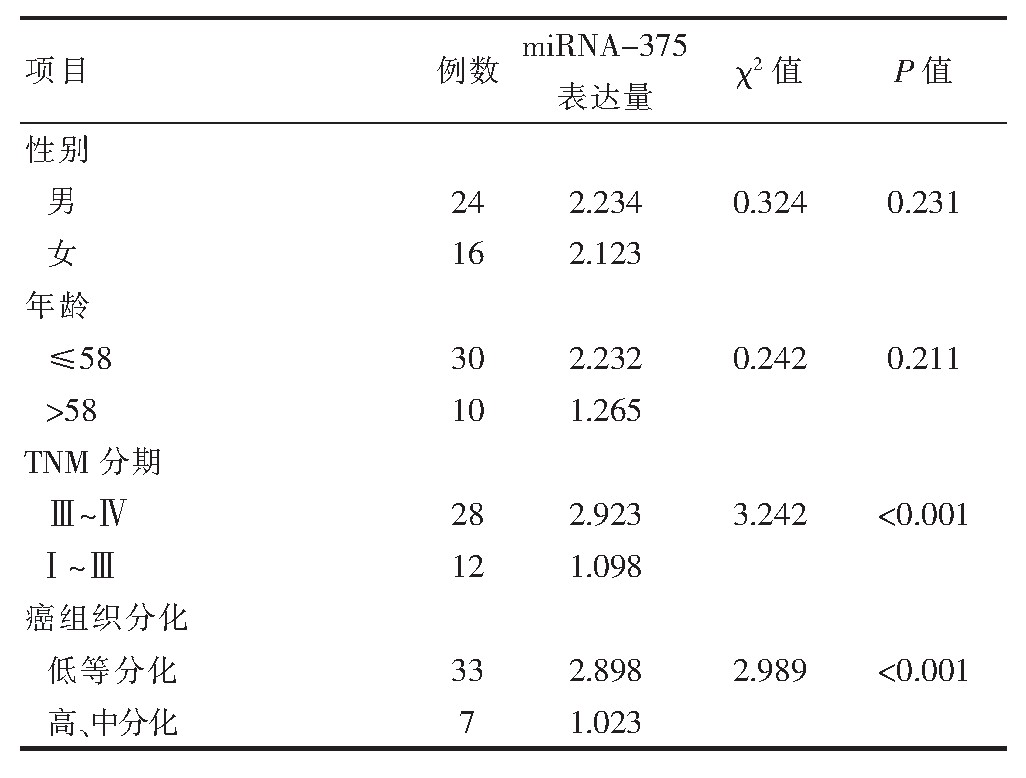
血清之中的mi RNA-375表达水平高低与患者的TNM分期情况,癌组织分化有关联,差异有统计学意义(P<0.05)。mi RNA-375的含量和表达水平高低与患者的年龄和性别之间差异无统计学意义(P>0.05),见表2。
表2 观察组患者血清中mi RNA表达水平影响因素分析(2-ΔC1)
3 讨论
mi RNA是一种内源性的小分子非编码形RNA,其稳定性较高,且能够有效调节机体靶细胞基因的表达情况,并且有效参与调控机体的生命活动,在细胞乃至于肿瘤之中发生发展中,发挥着重要的调节作用。近年来,mi RNA被发现与癌症等疾病有着较强的关联度[7],因此其逐渐成为了临床对于肿瘤标志物的重要选择,该次研究中首先选择了几种具有代表性的mi RNA,并通过文献研究的形式讨论,充分探索了mi RNA对于肝癌患者的疾病指示作用,后来又通过对照实验的方式,全面的分析了mi RNA-375含量与肝癌患者年龄,性别,等等临床病理学参数之间的关系,以期探讨其疾病诊断价值[8]。
根据过往的临床研究不难发现,mi RNA-27a、mi RNA-30a、mi RNA-490等临床物质已经被证实与乳腺癌,胃癌等多种类型的临床恶性肿瘤密切有关,具体来说,在乳腺癌中,mi RNA-20a可以促进集体中的生长因子分泌乳腺癌肿瘤存活素等,并通过该物质的不断表达来促进肿瘤细胞的生长,分化和后期转移[9]。临床证明,mi RNA-27a在乳腺癌中呈现高表达态势,且表达数量越高,乳腺癌的预后相对更差,5年之内的存活率低。对于前列腺癌症,恶性肿瘤指导表示因子mi RNA-30a可以通过对干细胞生长因子的干预,有效抑制表皮生长因子的表达,患者的前列腺细胞中皮间质转化被抑制,肿瘤扩散速度不断提高[10]。在该次研究中,全面研究了mi RNA中mi RNA-20a与mi RNA-30a的表达情况与患者疾病情况的对比,结果发现,对于肝癌患者和正常肝病患者的临床分析中,mi RNA-490被认为是一种可能的抑制癌症基因,现阶段已经从膀胱癌,结直肠癌等恶行肿瘤中表达差异不显着,但是在肝癌患者和肝疾病患者中呈现上调态势。但是在该次研究中,mi RNA-27a、mi RNA-30a、mi RNA-490 3种物质的表达含量差异无统计学意义(P>0.05)。但是3种物质与肝癌之间的关系需要进一步确定。
Mi RNA-375基因的生物学功能较为强大,能够进行各类临床癌症基因的转录,并有效控制着细胞的生长增殖等,很多甚至参与了葡萄糖对胰岛素分泌等,在临床的恶性肿瘤之中,mi RNA-375的身份为癌基因,并直接影响着各类恶性肿瘤的生长和转移[12-14]。该次研究表明40例肝癌患者血清中mi RNA-27a、mi RNA-30a、mi RNA-490基因在观察组和对照组之间差异无统计学分析意义(P>0.05)。血清mi RNA-375含量变化情况显着,基因在观察组和对照组之间差异有统计学意义(P<0.05)。mi RNA-375的含量和表达水平高低与患者的年龄和性别之间差异无统计学意义(P>0.05),血清中的mi RNA-375水平高低与患者的TMN分期情况、癌组织分化有关联(P<0.05)。李俊等研究表明[11],原发性肝癌组患者血清mi RNA-375表达量低于肝硬化组、肝炎组和健康对照组,差异有统计学意义(P<0.01);mi RNA-375在原发性肝癌组、肝硬化组、肝炎组和健康对照组血清中的表达量,差异有统计学意义(P<0.01);原发性肝癌组患者经肝动脉栓塞化疗治疗后mi RNA-375表达量为较治疗前上升,差异有统计学意义(t=7.658,P<0.01),与该研究结果一致。王保永等[15]研究主要探讨了肝癌患者与一般肝部疾病患者体内的mi RNA表达情况,结果发现,RT-PCR检测肝癌组织及癌旁组织中mi RNA表达显示,一般肝病患者中mi RNA-375的含量是2.234,与癌旁组织肝病患者3.233相比,mi R-375的m RNA在肝癌组织中的表达水平明显降低,差异有统计学意义(P<0.01),其结果与该研究结果一致。
综上所述,mi RNA-375在肝癌患者的血清中表达含量增加,可以进行肝癌的疾病预后评判指标,且其在临床病理学分期,肿瘤细胞分化程度等方面有着较好的指示性作用。
参考文献
[1]高洁芳,张洪,吕舰,等.miRNA-196a-2 rs11614913单核苷酸多态性与中国人群中原发性肝细胞肝癌发病风险的Meta分析[J].癌症进展,2019,17(17):2011-2015.
[2]赵静,杨兴武,李京涛,等.基于高通量测序的肝癌circRNA-miRNA-mRNA调控网络构建及功能富集分析[J].临床肝胆病杂志,2019,35(8):1740-1744.
[3]刘源,倪渐凤,李芳芳,等.miRNA-196b靶向抑制IGF2BP1对肝癌HepG2细胞增殖和凋亡的影响及机制研究[J].癌症进展,2019,17(13):1557-1560.
[4]张蕾,龚泽众,李岩.miRNA-223在肝癌中的研究进展[J].大连医科大学学报,2019,41(3):272-276.
[5]石蕾.MiRNA-9在肝癌患者的表达水平及临床意义[J].现代实用医学,2019,31(6):726-728.
[6]李章勇,夏川,李刚勇,等.肝纤维化指标与miRNA-200b、TAP联合检测与原发性肝癌预后的相关性研究[J].国际检验医学杂志,2019,40(11):1317-1320.
[7]常允建,康冉,薛璇,等.肝癌中增强子调控miRNA前馈环路的识别与功能分析[J].生物技术通报,2019,35(5):140-145.
[8]李为,胡明道,陈鹏.MiRNA调控EMT影响肝癌侵袭转移的研究进展[J].世界最新医学信息文摘,2019,19(37):45-46,49.
[9]胡晓晓.肝癌细胞中CCAAT增强子结合蛋白α通过组蛋白去乙酰化酶(HDACs)-miRNA上调的机制研究[D].南宁:广西医科大学,2019.
[10]宋秀道,马锦.基于生物信息学分析miRNA-195-5p在肝癌中的表达及其临床意义[J].生命科学研究,2019,23(2):100-107.
[11]李俊,郭旭利,黄维甄.miR-375、miR-146a在原发性肝癌患者预后评估中的价值[J].肝脏,2019,24(3):268-271.
[12] Semik Malgorzata,Tyrka Miroslaw,Ciszkowicz Ewa, et al.Combination of three miRNA(miR-141, miR-21, and miR-375)as potential diagnostic tool for prostate cancer recognition[J].International Urology and Nephrology,2018,50(9):1619-1626.
[13] Arvidsson Yvonne,Wangberg Bo,Rehammar Anna, et al.miRNA profiling of small intestinal neuroendocrine tumors defines novel molecular subtypes and identifies miR-375 as a biomarker of patient survival[J].Modern pathology,2018,31(8):1302-1317.
[14] Xu Li-Ping,Xu Tailin,Song Yongchao, et al.Nanodendritic gold/graphene-based biosensor for tri-mode miRNA sensing[J].Chemical communications,2019,55(12):1742-1745.
[15]王保永,夏艳丽,肖鸿丽,等.miRNA-138靶向调控细胞周期蛋白D3及波形蛋白影响肝癌细胞的增殖及迁移[J].重庆医学,2019,48(12):1986-1990,1995.
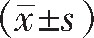 表示,行t检验;计数资料用频数和百分比(%)表示,行χ2检验,P<0.05为差异有统计学意义。
表示,行t检验;计数资料用频数和百分比(%)表示,行χ2检验,P<0.05为差异有统计学意义。

