某三甲肿瘤专科医院伦理委员会伦理审查能力影响因素分析
摘要:目的:通过对伦理委员会伦理审查效率和伦理审查质量两方面的评估,发现影响伦理审查效率和质量的主要因素,为提升伦理审查能力提出建议。方法:分析2016~2018年某三甲肿瘤专科医院医学伦理委员会审查的440项研究项目的相关环节耗时情况和不同审查方式、审查类别的项目的审查决定情况。结果:科研项目初始审查会议审查、快速审查批准耗时平均为22天、0天,跟踪审查会审、快审平均等待21天、2天; GCP项目初审平均等待16天,平均审批20天,跟踪审查会审、快审平均等待27天、2天,跟踪审查会审批准耗时平均0天。初始审查中,2016、2017、2018年审查决定为“同意”占20. 00%、36. 73%、47. 83%,此三年跟踪审查审查决定为“同意”的构成比为98. 16%。结论:建议通过提高伦理会议频率、加强伦理委员会与申办方和研究者的沟通、实行跟踪审查主审负责制、加大委员和研究者培训力度、完善伦理办公室信息化管理来提升伦理审查能力。
关键词:伦理审查能力; 伦理委员会; 审查效率; 审查质量;
2017年中共中央办公厅/国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[1]提出“提高伦理审查效率”,而国家药品监督管理局也意欲通过改进审批程序提高审批效率[2],其中就包括审批环节中伦理审查的效率。伦理审查科研项目日益增多、新药临床试验项目也与日俱增,但是,伦理审查效率和伦理审查质量能否跟上科研、新药的发展步伐,成为为其助力的强有力环节?亟待伦理工作者探讨研究。目前虽然可以通过伦理审查委员会能力拓展战略方案认证[3-4]、美国的人体研究保护体系认证协会认证[5-6]、中医药研究伦理审查体系认证[7-8]等外部认证[9]来对伦理委员会的伦理审查和受试者保护体系质量进行总体评估,但是在实际工作中,如何运用日常工作记录对伦理审查效率和质量进行常态化的监督调整,并没有公认的定量评价指标和办法[10]。而对于肿瘤专科医院伦理委员会如何提高伦理审查能力国内亦未见相关报道。本文欲通过回顾性分析2016~2018年四川省某三甲肿瘤专科医院医学伦理委员会审查的440项研究项目,采用相关定量指标对该院医学伦理委员会伦理审查效率和伦理审查质量两方面进行评估,从而发现影响伦理审查效率和审查质量的主要因素。该分析结果可为提高审查效率、优化审查质量提出实操性的建议,达到提升伦理委员会审查能力的最终目的。
1 对象与方法
1.1 对象
2016年1月1日至2018年12月31日,该院医学伦理委员共完成伦理审查440项,包括科研项目和GCP项目两类。其中,初始审查143项,复审80项,跟踪审查217项。初始审查中,获取批件项目134项,包括会议审查106项,快速审查28项;复审中,会议审查25项,快速审查55项;跟踪审查中,获批通过的项目216项,含会审188项,快审28项。
1.2 方法
数据收集方法:根据该院医学伦理委员会伦理审查流程(流程图见图1),从伦理审查的原始文件中分别提取初始审查项目初审日期、复审日期、伦理批件生效日期,提取跟踪审查的材料递交日期、跟踪审查日期、复审日期、伦理决定文件生效日期,提取审查项目的审查方式、审查类别和审查决定等。根据收集到的日期信息,计算伦理审查各个环节耗时。根据审查类别、审查方式和审查决定信息,计算其绝对数值和(或)构成比。

图1 伦理审查流程图
Figure 1.Flowchart of Ethics Review
统计分析方法:采用Excel软件建立原始数据库,计算调查指标。运用SPSS 22.0统计软件对定量资料进行统计描述,根据数据特征,采用中位数、四分位数间距、最小值和最大值进行描述。采用成组设计多个样本比较的秩和检验对3年的审查耗时进行差异性分析,两两比较采用成组设计两样本比较的Wilcoxon秩和检验。检验水准α=0.05(两两比较时校正检验水准α=0.017)。
1.3 调查指标
等待审查耗时是指审查受理(即材料递交)到进行伦理审查(会议审查或快速审查)的天数。
审查批准耗时是指进行伦理审查到获得伦理审查批准件的天数。其中,首次审查结果为同意的项目可直接获得批准件,审查批准耗时为0天。
本研究中所用时间均根据自然日计算。
2 结果
2.1 伦理审查效率分析结果
2.1.1 审查相关环节耗时情况分析结果
根据2016~2018三年在该院医学伦理委员会审查的项目原始信息计算出伦理审查相关环节耗时情况分布如表1所示。
分析结果显示:科研项目初始审查会议审查批准耗时最短0天,最长273天,平均22.0天拿到批件。其快速审查批准耗时最短0天,最长30天,平均0.0天。科研项目跟踪审查会审从递交纸质资料到开始审查等待耗时最短0天,最长102天,平均等待21.0天;快审平均等待2.0天,最短1天,最长19天。科研项目跟踪审查的会审、快审批准耗时均平均0.0天。
表1 2016~2018年伦理审查相关环节耗时情况[中位天数(最短天数,最长天数)]
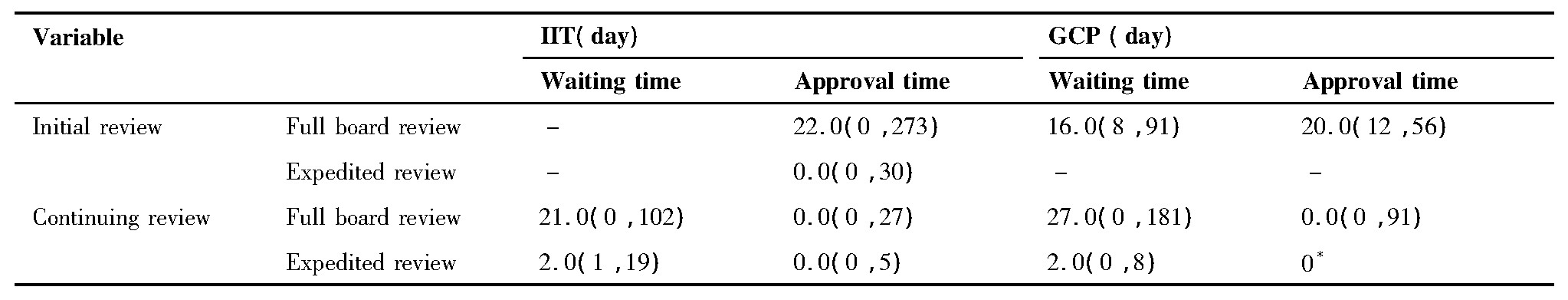
新药临床试验项目初始审查均为会议审查,平均等待耗时16.0天(最短8天,最长91天);平均审批耗时20.0天(最短12天,最长56天)。跟踪审查的会审平均等待27.0天(最短0天,最长181天),快审平均等待2.0天(最短0天,最长8天);跟踪审查的会审批准耗时平均0.0天(最短0天,最长91天)。
2.1.2 三年审查耗时差异性比较结果
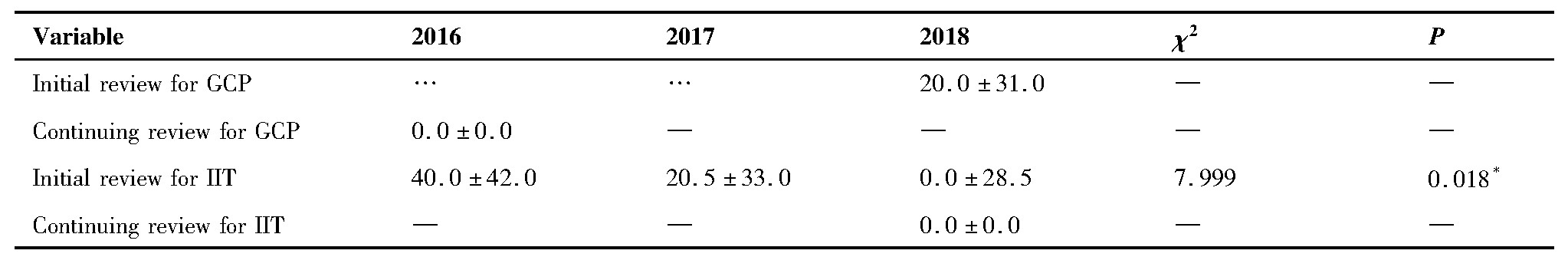
对2016~2018年伦理审查等待耗时和批准耗时进行三年的差异性比较分析,结果如表2、3。可知,GCP项目跟踪审查等待耗时三年差异有统计学意义,进一步两两比较,2016年与2017年比较统计量Z=-3.009,P=0.003<0.017,2016年与2018年比较统计量Z=-3.813,P<0.001<0.017。科研初审批准耗时三年差异有统计学意义,两两比较显示,2016年与2018年比较统计量Z=-2.816,P=0.005<0.017。
表2 2016~2018各年伦理审查等待耗时统计表(中位数±四分位数间距)(天)
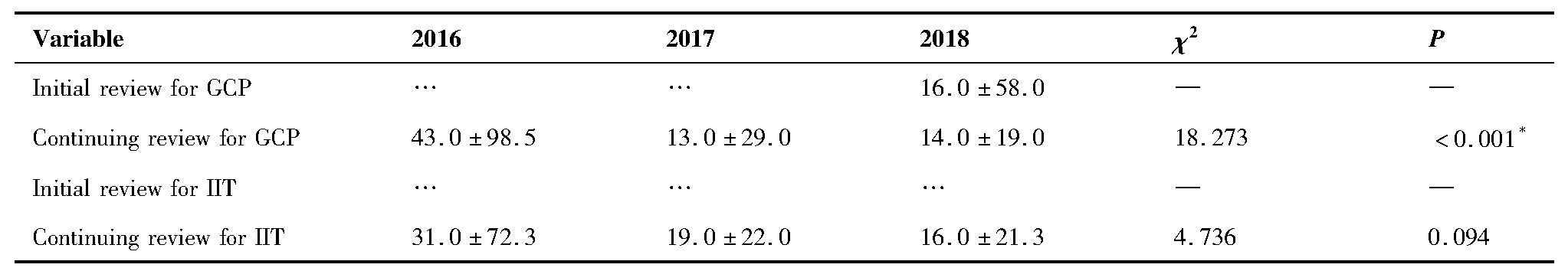
表3 2016~2018各年伦理审查批准耗时统计表(中位数±四分位数间距)(天)
2.2 伦理审查质量分析结果
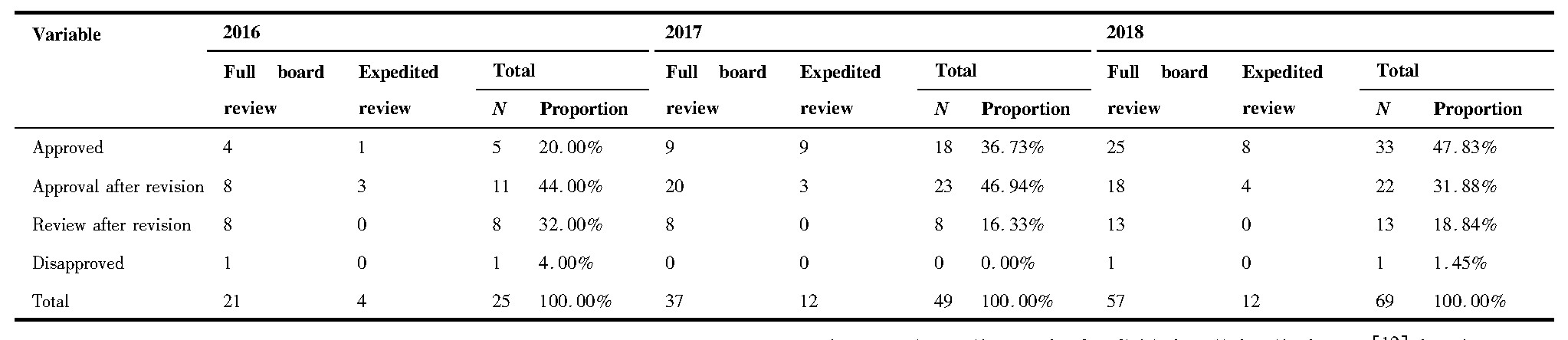
2016~2018年度伦理审查类别、伦理初始审查决定类别统计分析结果(含科研项目和GCP项目)如下表4、5所示。可以看出,2016、2017、2018年会议审查主要类别均为初始审查,分别占25.00%、35.58%、40.43%。在初始审查中,2016、2017、2018年审查决定为“同意”占20.00%、36.73%、47.83%,“修改后同意”为44.00%、46.94%、31.88%,“修改后重审”为32.00%、16.33%、18.84%。
2016~2018年度伦理跟踪审查决定类别项目数统计结果显示:跟踪审查审查决定为“同意”的构成比为98.16%(213/217)。这三年科研项目合计跟踪审查116项,其中,审查决定为“同意”113项,“修改后同意”3项;GCP项目,跟踪审查共101项,其中,“同意”100项,“修改后同意”1项。
表4 2016~2018年伦理审查类别统计表
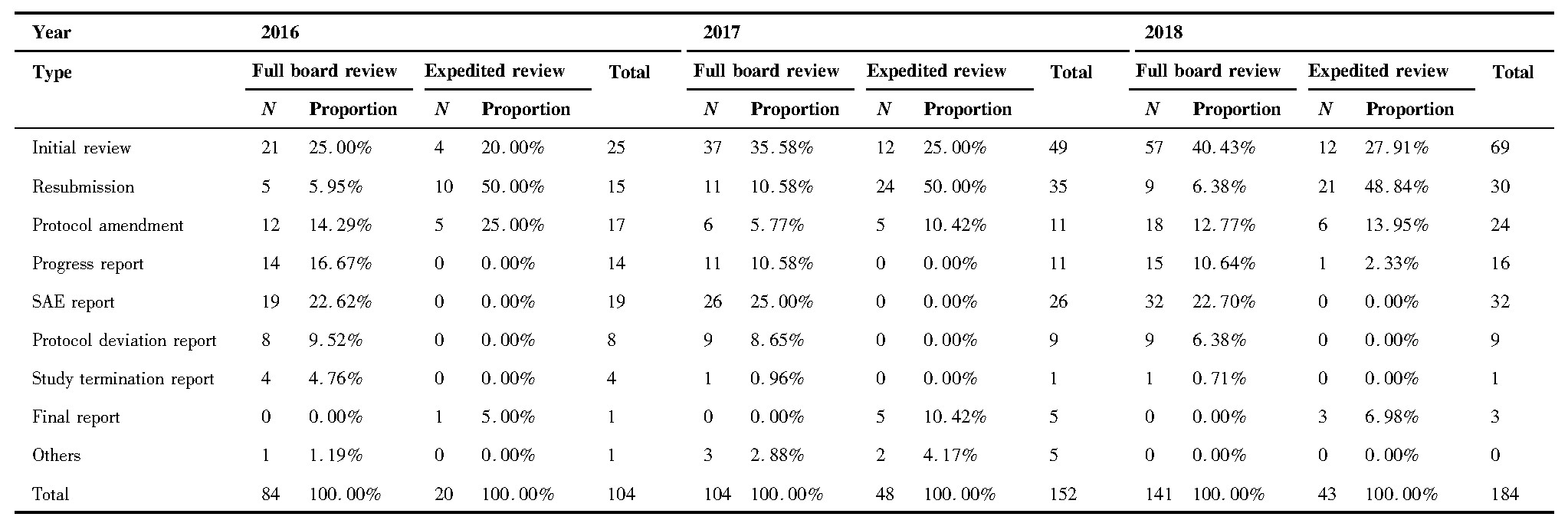
表5 2016~2018年伦理初始审查决定类别统计表
3 讨论
3.1 审查耗时平均天数较低,但存在个别项目积压时间较长的现象
伦理审查相关环节耗时分析结果显示:科研项目初始审查会审批准平均耗时22.0天,略低于文献报道[11]。最长273天的项目,回溯其原始文件,共复审两次:第一次为会审,递交资料后当月上会,第二次为快审,审查耗时5个工作日,可见两次复审伦理审查耗时合计不超过35天。而审查批准耗时大部分为申办方修改资料用时。科研项目初始审查快审批准耗时平均0.0天,明显少于文献报道[11]。科研项目跟踪审查等待耗时和批准耗时结果基本符合该院伦理委员会当月安排跟踪审查上会、快速审查在11个工作日内完成的标准操作规程[12]规定。
新药临床试验项目初始审查均为会议审查,平均等待耗时16.0天,高于文献报道[11];平均审批耗时20.0天,略低于文献报道[11]。跟踪审查的会审平均等待27.0天,最长181天,此个别项目等待时间较长主要是受2015年12到2016年3月伦理委员会整改期间连续4个月未召开伦理审查会议影响,导致2015年受理的GCP项目16项积压至2016年4月审查,计算除此16项的会审平均等待耗时为20.0天,最长104天。
3.2 三年审查效率有持续提高的趋势
由2016~2018年三年的GCP跟踪等待耗时、科研初审批准耗时差异性分析结果可知,三年耗时不全相等,其中,2018年均与2016年差异有统计学意义,可以认为2018年比2016年等待耗时、批准耗时有明显降低。这也与2016~2018三年开会次数分别为6、9、11次相吻合。2016年召开伦理会议6次,没有达到较稳定的伦理会议时间间隔,偶有两次会议间隔较长,从而出现个别项目积压时间较长的问题。当2017、2018年开会频率提高,会议间隔稳定后,等待、批准耗时均明显降低,可见,提高开会频率,保证稳定会议间隔对减少积压的重要作用。但是,随着审查项目日益增多,为了保证审查质量,伦理会议初审采用“限项制”,也是导致偶有项目积压的原因之一。
3.3 初始审查质量较高,跟踪审查质量较低
2016~2018年伦理审查类别、伦理初始审查决定类别构成比分析结果显示:会议审查初审的一次性通过率不高,常有审查意见提出,审查质量较好。快速审查的初审2017、2018年显示“同意”构成比较高达75.00%、66.67%,其原因在于符合快审标准的初始审查项目,受益风险比不大于最小风险,一次性通过率高亦在情理之中。而2016年快审初审的构成比较小,可能是因为样本量较小导致构成比不可信。而跟踪审查一次性通过率高达98.16%,可见,跟踪审查并没有完全落到实处,其审查质量较低。
3.4 针对肿瘤相关研究的伦理思考
2016~2018年完成的143项初始审查项目中肿瘤相关研究占97.90%。肿瘤相关临床研究具有其独特性:1)肿瘤新药种类较多,初始审查工作量大;2)肿瘤药物临床试验周期长,每项研究对应跟踪审查数量多;3)弱势群体问题较普遍;4)癌症患者知情问题需予以关注;5)肿瘤组织样本提取、保存、检测也需伦理考量[13]。目前,如3.3所述,该院医学伦理委员会针对肿瘤相关的科研项目和GCP项目均以较高质量完成了初始审查,回顾性研究亦不例外[14]。但研究周期长的肿瘤相关项目跟踪审查质量较低问题更显突出,亟需解决。由于在审查工作表中包含弱势群体、知情告知、组织样本等条目,委员不会忽视。但其均为主观判断,与伦理委员审查水平密切相关。
3.5 提升伦理审查能力的相关建议
通过对伦理审查效率和审查质量以上两方面的分析研究,发现影响医学伦理委员会伦理审查能力的主要因素,从而提出提升审查能力的改进建议如下:1)提高伦理会议频率,修订会议审查标准,“抓大放小”:在遵循国家法律法规、指导原则的前提条件下,扩大快速审查范围,集中精力对风险比较大的项目进行会议审查,从而增加会议审查初审限项数量、提高审查效率;2)分类总结伦理审查意见,完善形式审查内容,加强沟通:审查批准耗时主要影响因素为申办方或研究者根据审查意见修改相关资料用时。除了申办方或研究者自身原因外,伦理委员会应考虑如何帮助其提高修改效率。另外,伦理委员会需加强与申办方和研究者的沟通交流,注重信息传达方式,出具审查意见时应尽可能详尽、清晰,一次性提出全部修改意见;3)提高跟踪审查能力,实行主审负责制,加强委员培训:跟踪审查质量较低,缺乏切实有效的监督审查。2016年国家卫计委新颁布的《涉及人的生物医学研究伦理审查办法》[15]反映了对跟踪审查的关注,“中心伦理审查”概念的提出,以及肿瘤项目的研究周期长的特点都凸显了跟踪审查的重要性。建议考虑跟踪审查采用主审负责制,某项目初审的主审委员将一直负责该项目的各项跟踪审查。另外,建议加强伦理委员跟踪审查、肿瘤项目特殊关注点审查的相关培训。为增强培训效果,可考虑案例讨论、实际操作与知识讲授相结合的方式;4)加大院内宣传力度,提高相关人员的伦理认识,扩大受众:申办方或研究者修改耗时较长、委员跟踪审查能力有待提高均需要通过培训来进行改善。面向研究者的培训要着力使研究者正确认识伦理委员会与研究者之间的合作伙伴关系,认识伦理审查为科研助力的关系。从审查的实际情况看,极少数研究方案被伦理委员会否决,大多数在委员会帮助下完善,得到批准,促进研究更好地开展[16];5)完善伦理办公室信息管理,注重数据收集,及时发现问题:与信息管理系统相结合,加强项目相关信息和审查系列信息的数据收集,为今后医学伦理委员会管理状况研究提供证据支持。
参考文献
[1]中共中央办公厅国务院办公厅.关于深化审评审批制度改革鼓励药品医疗器械创新的意见(2017年第29号)[EB/OL].http://www.gov.cn/gongbao/content/2017/content_5232362.htm,2017-10-08/2019-06-19.
[2]国家食品药品监督管理总局.关于药品注册审评审批若干政策的公告(2015年第230号)[EB/OL].http://samr.cfda.gov.cn/WS01/CL0087/134665.html,2015-11-11/2019-06-19.
[3]Forum for Ethical Review Committees in the Asian&Western Pacific Region.Formation of FERCAP[EB/OL].http://fercap-sidcer.org/whatsfercap.php,2014-01-05/2020-01-16.
[4]Forum for Ethical Review Committees in the Asian&Western Pacific Region.SIDCER Recognition Programme[EB/OL].http://www.fercap-sidcer.org/recog.php,2014-01-05/2020-01-16.
[5]Association for the Accreditation of Human Research Protection Program.AAHRPP Accreditation Standards[EB/OL].http://www.aahrpp.org/apply/process-overview/standards,2020-01-16.
[6]Association for the Accreditation of Human Research Protection Program.About AAHRPP[EB/OL].http://www.aahrpp.org/learn/about-aahrpp/our-mission.2020-01-16.
[7]世界中医药学会联合会.CAP认证简介[EB/OL].http://ethics.wfcms.org:88/a/guanyuwomen/,2020-01-16.
[8]世界中医药学会联合会伦理审查委员会.学会介绍[EB/OL].http://www.wfcms.org/ethics/To FLearn Introduction,2020-01-16.
[9]马喜桃,陆华,罗晓琼,等.SIDCER、AAHRPP认证和CAP认证的比较研究[J].医学与哲学,2016,37(5)∶32-35.
[10]Grady C.Do IRBs protect human research participants?[J].JA-MA,2010,304(10)∶1122-1123.
[11]白桦,孙燕,宋亚京,等.影响伦理审查速度的因素分析[J].中国医学伦理学,2016,29(3)∶465-468.
[12]国家食品药品监督管理局.药物临床试验伦理审查工作指导原则(2010年第436号)[EB/OL].http://www.gov.cn/gzdt/2010-11/08/content_1740976.htm.2010-11-02/2019-06-19.
[13]Penel N,Lebellec L,Smis P,et al.Management of tumor tissuein cancer clinical trials:Anethical perspective[J].Bull Cancer,2019,106(11)∶1064.
[14]李俏丽,李超,王薇,等.口腔、口咽鳞状细胞癌中HPV感染与EGFR之间的相关性研究[J].肿瘤预防与治疗,2018,31(2)∶78-83.
[15]卫生和计划生育委员会.涉及人的生物医学研究伦理审查办法(2016年第11号)[EB/OL].http://www.gov.cn/gongbao/content/2017/content_5227817.htm.2016-10-12/2019-06-19.
[16]邱仁宗,翟晓梅.有关机构伦理审查委员会的若干伦理和管理问题[J].中国医学伦理学,2013,26,(5)∶545-550.





