人羊膜和牙周膜来源间充质干细胞免疫表型与干性标志基因表达的比较分析
摘要:目的 研究羊膜和牙周膜来源间充质干细胞的免疫表型及干性基因表达的异同。方法 取羊膜和牙周膜各3例,采用酶消化法分离细胞并进行细胞传代培养,获取第3代人羊膜间充质干细胞(hAMSCs)与人牙周膜干细胞(hPDLSCs),流式细胞术检测分子免疫表型,实时定量PCR检测干性标志基因表达水平。结果原代培养的hAMSCs生长速度快于hPDLSCs,后者形态均一;第2、3代细胞均生长良好,每3天可传代1次,第3代hAMSCs和hPDLSCs都为均一的长梭形,呈旋涡状排列,均高表达CD90、CD73、CD105和CD44,表达百分率高于98%;hAMSCs的CD34、CD19、CD45、CD11b、人类白细胞抗原DR(HLA-DR)总阳性表达率低于hPDLSCs(P<0.05)。两种干细胞均不表达/低表达Sox2mRNA,而Nanog、Oct4和C-myc mRNA呈中高水平表达,差异无统计学意义(P>0.05)。结论 hAMSCs和hPDLSC具有相似的形态特征和免疫表型,且干性基因表达无明显差异,hAMSCs的免疫原性可能更低,应用前景较大。
关键词:间充质基质细胞 羊膜 牙周组织 免疫表型分型 干性基因
间充质干细胞(mesenchymal stem cells,MSCs)因具有来源广泛、易扩增、低免疫原性、多向分化、免疫调节、旁分泌等多种特征和功能而被广泛应用于造血干细胞移植、自身免疫性疾病以及心、肝、脑、肺、肾、骨、关节、脊髓、胰腺等组织器官损伤修复等治疗,在动物实验和临床研究中都显示了良好的疗效,同时也作为组织工程技术的种子细胞、药物活性筛选或药物载体被开发利用[1-4]。目前,研究最多的MSCs主要来源于骨髓、脂肪、脐带、尿液、羊膜、牙周膜、牙髓脐血等[5]。体内外研究表明,MSCs在特定条件下可定向分化为心肌、肝细胞、肾小管上皮细胞、成骨细胞、软骨细胞、神经细胞、胰岛细胞等,替代损伤的组织器官功能细胞[6-9];配合造血干细胞移植,还可改善造血微环境,提高造血干细胞移植成功率,减轻移植物抗宿主病[10];在肝损伤、脊髓损伤、膝骨关节炎的治疗中,MSCs的作用机制还涉及抗炎,分泌白细胞介素-10、胰岛素样生长因子-1、肝细胞生长因子、血管内皮生长因子等细胞因子和多种miRNA,促进血管和损伤组织再生等[11]。然而,不同组织来源MSCs的生物学特性既存在诸多的相似性,也具有不同之处。以往的研究表明,人羊膜MSCs(human aminiotic MSCs,hAMSCs)较骨髓MSCs而言,明显具有伦理限制小、可无创取材、细胞增殖能力强、免疫原性低、原始和扩增数量级高等突出优势[11]。尽管hAMSCs治疗的临床应用还有待进一步确证,但可能在未来组织工程技术发展中具有更诱人的应用前景。人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)在成体取材的创伤和风险远小于骨髓MSCs,二者都同样来源于废弃组织,具有伦理争议低、来源广泛等特点,且在成软骨方面要强于牙髓来源MSCs,能够形成致密规整的软骨细胞团,可作为牙再生的种子细胞[12-13]。因此,本研究主要从免疫表型和干性标准基因表达两个方面比较了羊膜和牙周膜来源MSCs的异同,为进一步合理利用干细胞资源治疗不同疾病奠定基础。
1 材料与方法
1.1 主要试剂与仪器
碱性成纤维细胞生长因子(b-FGF,美国PeproTech公司),低糖DMEM(L-DMEM)培养基、胎牛血清(以色列Biological Industries公司),α-MEM培养基、胶原酶I、胶原酶Ⅱ和胰酶(美国Gibco公司),Human MSCs分析试剂盒(美国BD Bioscience公司),藻红蛋白(PE)标记的CD105(CD105-PE,美国Beckman Coulter公司),RNAiso Plus、PrimeScript TM RT试剂盒、TB GreenTM Premix Ex TaqTM(大连Takara公司);CO2培养箱、7500定量PCR仪(美国Applied Biosystems公司);DMIRB倒置荧光显微镜(德国Leica公司),Moflo XDP流式细胞仪(美国Beckman Coulter公司)。
1.2 方法
1.2.1 hAMSCs的分离和培养
经知情同意后,采集甲型肝炎病毒、乙型肝炎病毒和获得性免疫缺陷病毒及梅毒螺旋体血清学检测阴性者的足月分娩胎盘,无菌条件下剥离羊膜,参考文献和本实验室已建立的方法[11,14]。采用二酶消化法,分离hAMSCs,以补充了0.1ng/mL b-FGF、10%胎牛血清L-DMEM完全培养基悬浮细胞,按1×105cells/cm2的密度接种hAMSCs于25cm2细胞培养瓶中,置于37℃、5%CO2细胞培养箱中培养;第3天更换培养基,至细胞生长至瓶底面积80%左右,采用0.125%胰酶[含0.02%乙二胺四乙酸(EDTA)]消化细胞,以1×105 cells/cm2的密度传代培养,至第3代,用于后续实验,倒置相差显微镜下观察细胞形态和生长状态。
1.2.2 hPDLSCs的分离和培养
经知情同意后,采集12~18岁青少年患者(无牙周炎症)因正畸需要拔除的双侧上、下颌健康前磨牙。拔出后立即用无菌生理盐水冲洗,并置于15mL装有含1%双抗的α-MEM培养基的离心管中,转移到超净工作台;再次冲洗至液体清亮,无菌刀片刮取根中1/3的牙周膜组织,加入0.3%Ⅰ型胶原酶37℃恒温摇床消化30min,含10%胎牛血清α-MEM完全培养基终止消化;800r/min离心5min,弃上清液,完全培养基2mL重悬细胞沉淀,接种于6孔板,置入37℃、5%CO2培养箱中,每3天换液1次,至细胞生长至瓶底面积60%时,用0.125%胰酶消化、传代,取第3代细胞进行实验。
1.2.3 流式细胞术分析细胞免疫表型
PBS重悬终止消化的第3代MSCs,调整细胞密度为(3~5)×106 cells/mL,分为7管,每管100μL细胞悬液,按照Human MSCs分析试剂盒和CD105抗体说明书分别加入异硫氰酸荧光素标记的CD90(CD90-FITC),藻蓝蛋白标记的APC(CD73-APC),CD44-PE,CD105-PE,PE标记的CD34、CD45、CD11b、CD19,人类白细胞抗原DR(HLA-DR)抗体及其同型对照,室温避光孵育25 min,加入2 mL含2%FBS的PBS溶液洗涤,1 000r/min离心6min,重复洗涤1次,300μL含2%多聚甲醛的固定液重悬细胞,采用Moflo XDP流式细胞仪进行检测,KALUZA软件分析MSCs表型分子表达的百分率。
1.2.4 实时荧光定量PCR(RT-PCR)检测干性基因表达水平
取终止消化的指数生长期第3代干细胞,PBS洗涤2次,将细胞沉淀溶于1mL RNAiso Plus中,参照试剂说明书提取总RNA,经Nanodrop 2000C浓度测定仪测定RNA浓度,调整反转录模板量为1μg,参照PrimeScript TMRT试剂盒说明书37℃15min,85℃5s进行逆转录;使用TB GreenTM Premix Ex TaqTM试剂盒进行Sox2、Oct4、Nanog、C-myc 4种干性标志基因及内参基因GAPDH的定量PCR扩增,引物序列见表l。PCR反应条件:94℃5min,94℃15s,60℃30s,40个循环,并添加溶解曲线分析步骤,计算目的基因的相对表达水平[15]。
表1 定量PCR扩增引物序列
 1.3 统计学处理
1.3 统计学处理
采用统计软件SPSS17.0进行统计分析,计量资料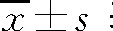 表示,组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
表示,组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞生长与形态观察
hAMSCs原代培养24~48h逐渐贴壁,7~10d细胞铺至瓶底面积达到80%左右,除可见梭形细胞外,还含有少量多角形或卵圆形细胞,传代培养时每3天传代1次,至第3代时,为均一、贴壁生长良好的长梭形细胞,呈旋涡状排列(图1A、B),传代生长至7代,均生长形态良好,9~10代细胞生长明显缓慢,形态变宽,并出现多角形细胞。hPDLSCs原代培养3d左右,从组织块周边开始爬行长出长梭形或多角形细胞,15~20d细胞融合度达到60%,培养至第2代后每3天传代1次(图1C、D),7代以内,细胞形态良好。
 图1 hAMSCs和hPDLSCs原代及第3代细胞生长形态比较(×100)
A:hAMSCs原代细胞形态;B:hAMSCs第3代细胞形态;C:hPDLSCs原代细胞形态;D:hPDLSCs第3代细胞形态。
2.2 免疫表型变化
图1 hAMSCs和hPDLSCs原代及第3代细胞生长形态比较(×100)
A:hAMSCs原代细胞形态;B:hAMSCs第3代细胞形态;C:hPDLSCs原代细胞形态;D:hPDLSCs第3代细胞形态。
2.2 免疫表型变化
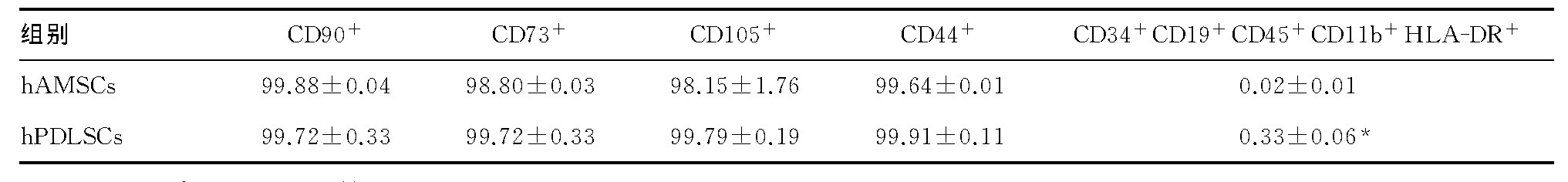
流式细胞术检测传代培养至第3代hAMSCs和hPDLSCs的分子免疫表型,表达百分率结果显示,两种干细胞均高表达CD90、CD73、CD105和CD44,阳性表达率高于98%,均不表达或极低地表达CD34、CD45、CD11b、CD19和HLA-DR,表达率总和均低于2%(图2)。hAMSCs和PDMSCs表达的前4个阳性标志免疫表型分子具有较好的一致性,但hPDLSCs的CD34+CD19+CD45+CD11b+HLA-DR+阳性表达率高于hAMSCs(P<0.05),见表2。
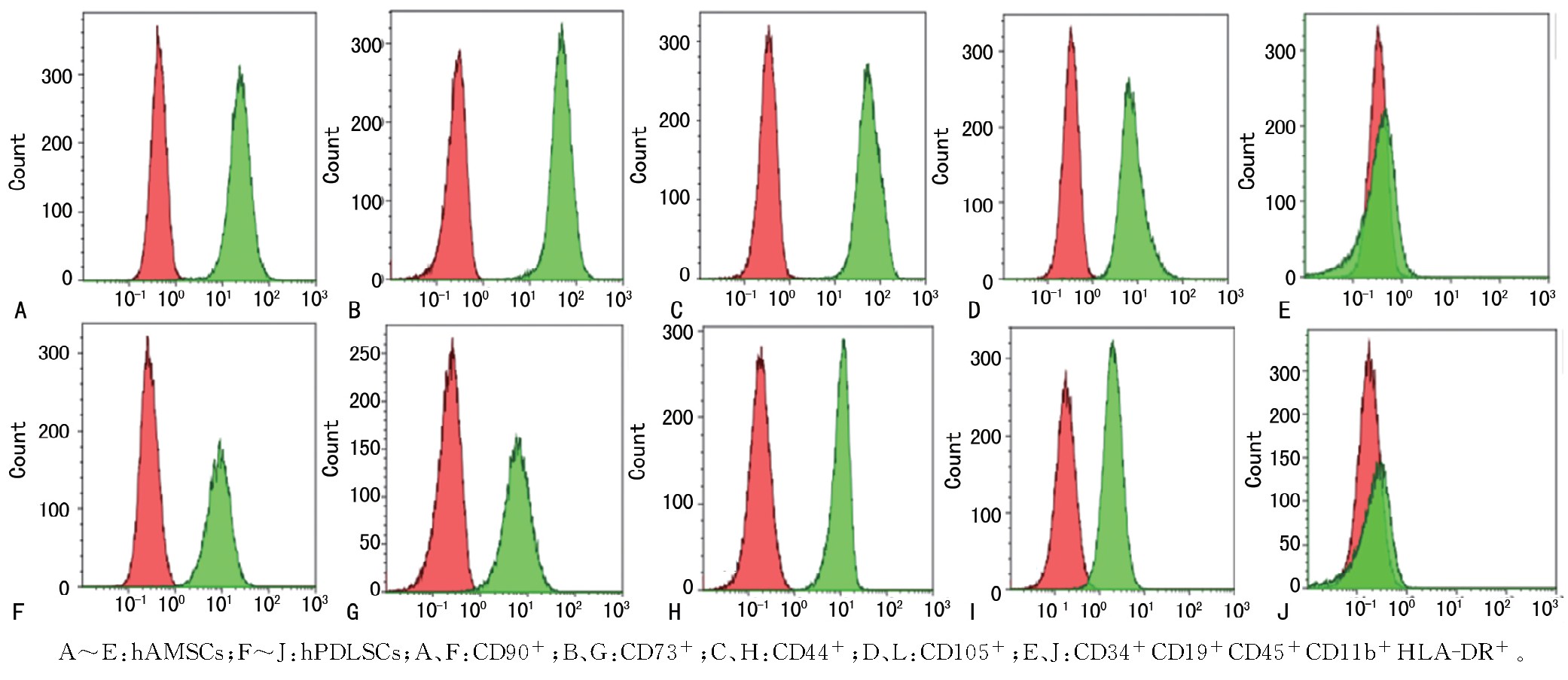 图2 hAMSCs和hPDLSCs的分子免疫表型流式检测分析图
表2 流式检测hAMSCs和hPDLSCs的分子免疫表型阳性表达率比较(n=3,,%)
图2 hAMSCs和hPDLSCs的分子免疫表型流式检测分析图
表2 流式检测hAMSCs和hPDLSCs的分子免疫表型阳性表达率比较(n=3,,%)
 2.3 4个干性基因mRNA表达水平
2.3 4个干性基因mRNA表达水平
体外培养至第3代的hAMSCs和hPDLSCs的4个干性基因相对表达水平见表3,两种干细胞Sox2、Oct4、C-myc和Nanog基因mRNA表达水平均无明显差异,其中Sox2(33.9<Ct<36.1)呈现不表达/低表达,而C-myc(21.1<Ct<23.1)、Oct4(26.9<Ct<27.5)和Nonog(29.3<Ct<30.6)基因为中高水平表达,Nonog和Oct4表达水平较为接近。
表3 hAMSCs和hPDLSCs 4个干性基因的mRNA相对表达水平比较(n=3,,×100%)

3 讨论
从细胞培养中观察到的细胞增殖和保持良好形态特征来看,hAMSCs较hPDLSCs原代培养增殖速度快,目前的培养体系扩增代次较多,加之hAMSCs原始数量级可高达1×108个细胞[11],这也可能是hAMSCs在大规模扩增和高数量级需求的细胞治疗及组织工程技术的应用中具有的明显优势。
自2006年国际细胞治疗协会提出骨髓MSCs的最低鉴定标准后,参照这一标准对不同来源的MSCs也进行了免疫表型分子表达分析,通常要求CD90、CD73、CD44、CD105的阳性表达百分率需大于95%,而CD34、CD19、CD45、CD11b及HLA-DR阳性表达的总和需小于2%[16-18],但尚缺乏对不同来源MSCs表达上述分子水平的比较研究。CD90+被认为是同造血干细胞CD34+一样的干细胞多能性标志物。CD105是细胞表面的I型膜糖蛋白,在血管生成中起着至关重要的作用。CD45、CD34、CD11b和CD19阳性表达则用来排除白细胞、造血祖细胞、内皮细胞、单核细胞和巨噬细胞及B淋巴细胞的标志分子。HLA-DR是人白细胞抗原复合物编码的MHCⅡ类细胞表面受体,是免疫原性的标志物。95%以上的hAMSCs和hPDLSCs均高表达CD90、CD73、CD44和CD105,仅不足1%的细胞表达CD34、CD45、CD11b、CD19和HLA-DR,显示出与骨髓MSCs相似的分子免疫表型特征,也表明hAMSCs和hPDLSCs均为间质来源的多能干细胞,具有较低的免疫原性;但是hPDLSCs表达CD34、CD45、CD11b、CD19和HLA-DR阳性的总百分率高于hAMSCs组,提示hPDLSCs的免疫原性可能高于hAMSCs。以往的研究表明,在相同剂量IFN-γ刺激下,hPDLSCs较牙髓干细胞高表达HLA-DR和CD50,而在对T淋巴细胞克隆增殖的调节研究中,hPDLSCs显示出缺乏抑制T淋巴细胞克隆性增殖的能力,也表明不同来源MSCs对免疫炎性反应可能存在的不同的应答能力[19]。
大量研究表明,Sox2、Nanog和Oct4参与胚胎干细胞(embryonic stem cells,ESCs)和MSCs的自我更新及多能性的调控,三者的平衡使ESCs处于稳定的自我更新状态,并具有多个胚层分化的能力,任何一个基因表达的改变都会引起ESCs向特定胚层细胞的分化能力改变[20-21]。其中,Nanog十分有利于维持ESCs处于稳定的未分化状态[22],并维持内细胞团细胞的多能性[23];Sox2在维持干细胞增殖和抑制定向分化中起到积极作用,并且Sox2基因在维持ESCs自我更新时需要保持其mRNA在较小的变化范围,两倍或更低水平的过表达Sox2基因都会诱导ESCs细胞分化为神经外胚层、中胚层和滋养外胚层细胞,但不会分化为内胚层细胞[24]。ESCs在向成熟滋养层细胞或中枢神经系统逐渐分化的过程中,Sox2表达逐渐下调,并且在终末分化的细胞中不表达[25]。体外实验证实,Sox2过表达可使胃癌细胞株MKN28发生增殖周期阻滞,并促进细胞凋亡。C-myc基因属于原癌基因,参与调控细胞的生长、分化、凋亡及自我更新,过表达会导致细胞的恶性增殖,与癌症发生密切相关[26];Oct4适宜的蛋白表达水平对于维持干细胞的多能性也十分重要,当Oct4表达受抑制,细胞周期抑制因子p21及分化相关基因p63表达上调[27]。本实验中,hAMSCs和hPDLSCs的上述4个干性基因表达水平均比较一致,其中较高水平的C-myc mRNA表达可能对保持干细胞的自我更新和增殖具有重要作用;其次是Nanog和Oct4表达水平相似,对于维持hAMSCS和hPDLSCs的干性和非分化状态具有重要意义;Sox2mRNA的不表达或极低表达,则提示体外培养到第3代的hAMSCs和hPDLSCs向神经细胞外胚层分化的能力相对较低。另有研究证明,Sox2敲除的小鼠ESCs只要维持Oct4的表达就可以阻止其分化[28],Sox2在干细胞中的表达下调优先于Oct4,当Sox2对Oct4的限制解除,以骨桥蛋白为代表的原始内胚层谱系的系列基因表达才逐渐升高[29],表明这两种MSCs目前保持了良好的中胚层来源特性,或许也提示第3代hAMSCs和hPDLSCs向内胚层细胞分化能力高于外胚层,并且Oct4在维持干细胞多能性方面可能更据主导地位。当然在特定诱导条件下,添加维生素C、正丁基苯酞、SFRP2等干预因素[30-32],在可保持Oct4表达的同时,上调Sox2的表达,仍可促进MSCs向外胚层细胞分化。
总之,培养至第3代的hAMSCs与hPDLSCs的形态学特征、免疫表型分子和干性基因表达方面具有一定的相似性,但hAMSCs的免疫原性可能更低。
参考文献
[1]高小月,张玉泉,杨晓清.人脐带间充质干细胞在组织损伤修复中的研究进展[J].生物医学工程与临床,2018,22(2):208-213.
[2] MCGIVERN J V,EBERT A D.Exploiting pluripotent stem cell technology for drug discovery,screening,safety,and toxicology assessments[J].Adv Drug Deliv Rev,2014,69/70:170-178.
[3] LI H J,SHEN S,FU H T,et al.Immunomodulatory functions of mesenchymal stem cells in tissue engineering[J].Stem Cells Int,2019(2019):9671206.
[4] MOHAMMADI M,JAAFARI M R,MIRZAEI H R,et al.Mesenchymal stem cell:a new horizon in cancer gene therapy[J].Cancer Gene Ther,2016,23(9):285-286.
[5] LIU R,ZHANG X,FAN Z,et al.Human amniotic mesenchymal stem cells improve the follicular microenvironment to recover ovarian function in premature ovarian failure mice[J].Stem Cell Res Ther,2019,10(1):299.
[6] YUAN J,HUANG G R,XIAO Z,et al.Overexpression ofβ-NGF promotes differentiation of bone marrow mesenchymal stem cells into neurons through regulation of AKT and MAPK pathway[J].Mol Cell Biochem,2013,383(1/2):201-211.
[7]孙海宁,雷海锋,王振清,等.鼻黏膜外胚层间充质干细胞诱导分化成骨细胞的实验分析[J].中国医药导报,2016,13(23):29-32,37.
[8] GUGLIANDOLO A,BRAMANTI P,MAZZON E.Mesenchymal stem cell therapy in Parkinson′s disease animal models[J].Curr Res Transl Med,2017,65(2):51-60.
[9] SCUTERI A,MONFRINI M.Mesenchymal stem cells as new therapeutic approach for diabetes and pancreatic disorders[J]I.ntJMolSci,2018,19(9):2783-2796.
[10]LIM J Y,RYU D B,LEE S E,et al.Mesenchymal stem cells(MSCs)attenuate cutaneous sclerodermatous graft-versus-host disease(SclGVHD)through inhibition of immune cell infiltration in a mouse model[J].J Invest Dermatol,2017,137(9):1895-1904.
[11]ZHAO R C.Stem cells:basics and clinical translation[M].Springer Science Business Media Dordrecht,2015:29-66.
[12]王飞翔,贺慧霞,贾雅丽,等.牙髓,牙周膜及脐带间充质干细胞三系分化能力的体外比较研究[J].口腔颌面修复学杂志,2016,17(3):129-134.
[13]张一帆,房兵.牙再生的研究进展[J].中国口腔颌面外科杂志,2017,15(6):564-568.
[14]余丽梅.一种完全培养基及人羊膜间充质干细胞的培养方法:CN102191218A[P].2011-03-28.
[15]XU S F,YU L M,FAN Z H,et al.Improvement of ginsenoside Rg1 on hematopoietic function in cyclophosphamide-induced myelosuppression mice[J].Eur J Pharmacol,2012,695(1/3):7-12.
[16]DOMINICI M,LE BLANC K,MUELLER I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[17]CONSENTIUS C,MIRENSKA A,JURISCH A,et alI.nsitudetectionofCD73+CD90+CD105+lineage:Mesenchymal stromal cells in human placenta and bone marrow specimens by chipcytometry[J].Cytometry A,2018,93(9):889-893.
[18]DE CESARIS V,GROLLI S,BRESCIANI C,et al.Isolation,proliferation and characterization of endometrial canine stem cells[J].Reprod Domest Anim,2017,52(2):235-242.
[19]VASANDAN A B,SHANKAR S R,PRASAD P A,et al.Functional differences in mesenchymal stromal cells from human dental pulp and periodontal ligament[J].J Cell Mol Med,2014,18(2):344-354.
[20]SILVA J,SMITH A.Capturing pluripotency[J].Cell,2008,132(4):532-536.
[21]NIWA H.How is pluripotency determined and maintained?[J].Development,2007,134(4):635-646.
[22]CHAMBERS I,SILVA J,COLBY D,et al.Nanog safeguards pluripotency and mediates germline development[J].Nature,2007,450(7173):1230-1234.
[23]SILVA J,NICHOLS J,THEUNISSEN T W,et al.Nanog is the gateway to the pluripotent ground state[J].Cell,2009,138(4):722-737.
[24]KOPP J L,ORMSBEE B D,DESLER M,et al.Small increases in the level of Sox2trigger the differentiation of mouse embryonic stem cells[J].Stem Cells,2008,26(4):903-911.
[25]STREBINGER D,DELUZ C,FRIMAN E T,et al.Endogenous fluctuations of OCT4and SOX2bias pluripotent cell fate decisions[J].Mol Syst Biol,2019,15(9):e9002.
[26]LEWIS L M,EDWARDS M C,MEYERS Z R,et al.Replication study:transcriptional amplification in tumor cells with elevated c-Myc[J].Elife,2018,7:e30274.
[27]GRECO S J,LIU K,RAMESHWAR P.Functional similarities among genes regulated by Oct4in human mesenchymal and embryonic stem cells[J].Stem Cells,2007,25(12):3143-3154.
[28]MASUI S,NAKATAKE Y,TOYOOKA Y,et al.Pluripotency governed by Sox2via regulation of Oct3/4expression in mouse embryonic stem cells[J].Nat Cell Biol,2007,9(6):625-635.
[29]BOTQUIN V,HESS H,FUHRMANN G,et al.New POU dimer configuration mediates antagonistic control of an osteopontin preimplantation enhancer by Oct-4and Sox-2[J].Genes Dev,1998,12(13):2073-2090.
[30]WEI F,QU C,SONG T,et al.Vitamin C treatment promotes mesenchymal stem cell sheet formation and tissue regeneration by elevating telomerase activity[J].J Cell Physiol,2012,227(9):3216-3224.
[31]陈俊,杨自金.鼠神经生长因子体外诱导脐血间充质干细胞向类神经元分化[J].中国组织工程研究,2018,22(13):2027-2032.
[32]LIN X,DONG R,DIAO S,et al.SFRP2enhanced the adipogenic and neuronal differentiation potentials of stem cells from apical papilla[J].Cell Biol Int,2017,41(5):534-543.

 表示,组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
表示,组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。



