白蛋白结合型紫杉醇联合奈达铂治疗晚期复发鼻咽癌的临床效果与安全性
摘要:目的 观察白蛋白结合型紫杉醇联合奈达铂治疗晚期复发鼻咽癌的临床效果和安全性。方法 回顾性分析2016年8月~2019年6月我院鼻咽癌晚期复发后接受紫杉醇类药物联合铂类化疗的78例患者的临床资料,将白蛋白结合型紫杉醇联合奈达铂化疗的患者作为观察组,将普通紫杉醇注射液联合奈达铂化疗的患者作为对照组,每组各39例。化疗4个周期后对两组患者的近期疗效、不良反应发生情况进行评估。结果 化疗4周期后,观察组患者的总缓解率高于对照组,差异有统计学意义(P<0.05)。两组患者的血液学毒性发生率比较,差异无统计学意义(P>0.05);非血液学毒性方面,观察组患者的皮疹、面部潮红和周围神经毒性发生率均低于对照组,差异有统计学意义(P<0.05);两组患者的恶心呕吐发生率比较,差异无统计学意义(P>0.05)。结论 对晚期复发鼻咽癌患者给予白蛋白紫杉醇联合奈达铂化疗,具有较好的临床效果,皮疹、面部潮红等过敏反应少,耐受性好。
关键词:白蛋白结合型紫杉醇 鼻咽癌 化疗
鼻咽癌是我国南方常见的恶性肿瘤,大约5%的患者诊断时即为晚期[1],虽然局部控制率目前有所改善,但远期转移是晚期复发患者的主要原因[2]。对于晚期复发鼻咽癌患者,全身化疗是主要治疗手段,紫杉醇类药物联合铂类化合物是晚期鼻咽癌化疗的方案之一[3-4]。由于紫杉醇水溶性低,制备普通注射液时添加了聚氧乙基蓖麻油作为助溶剂,因此在输注时容易引起过敏反应。而白蛋白结合型紫杉醇是一种新型的紫杉醇剂型,以纳米微粒白蛋白为载体,不仅改变了助溶剂,也明显提高疗效,减少不良反应,其在临床上主要应用于乳腺癌[5-6]、非小细胞肺癌[7]、胰腺癌[8]和黑色素瘤[9]。本研究旨在观察白蛋白结合型紫杉醇联合奈达铂作为晚期复发鼻咽癌治疗方案的临床效果和安全性,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年8月~2019年6月我院鼻咽癌晚期复发后接受紫杉醇类药物联合铂类化疗的78例患者的临床资料,将白蛋白结合型紫杉醇联合奈达铂化疗的患者作为观察组,将普通紫杉醇注射液联合奈达铂化疗的患者作为对照组。观察组39例,男20例,女19例;年龄28~70岁,平均(49.5±1.5)岁;病程10~36个月,平均(22.5±1.5)个月。对照组39例,男21例,女18例;年龄28~73岁,平均(50.5±1.5)岁;病程11~36个月,平均(23.5±1.5)个月。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:过往接受过化疗治疗的鼻咽癌复发患者,体力状况(PS)评分>2分。排除标准:过往接受过紫杉醇类药物联合化疗的患者;伴有严重心、肝、肾等器质性疾病的患者;化疗禁忌。本研究经过医院医学伦理委员会审核批准。
1.2 方法
观察组的化疗方案:白蛋白结合型紫杉醇(石药集团欧意药业有限公司,生产批号:B04190425、B04190406)260 mg/m2第1天,奈达铂(齐鲁制药有限公司,生产批号:6C0112B04、8L025B04)80 mg/m2第1天,21 d一周期,总共4周期。
对照组的化疗方案:紫杉醇注射液(意大利Cor den Pharma Latina S.P.,生产批号:5K03792、6D03892)175 mg/m2第1天,奈达铂80 mg/m2第1天,21 d一周期,总共4周期。
两组化疗药物配置和输注时间均按照说明书推荐。
1.3 观察指标及评价标准
化疗4个周期后对两组患者的近期疗效、不良反应发生情况进行评估。化疗的近期疗效采用实体瘤疗效评估标准(RECLST)进行评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),CR指全部病灶消失维持4周;PR指病灶最长径总和缩小30%及以上,并维持4周;PD指病灶最长径总和较前增加20%及以上,SD指病灶最长径增加范围不及PD,但缩小范围又不及PR,即PR<SD<PD。总缓解率=(CR+PR)例数/总例数×100%。化疗不良反应以实际化疗反应例数计算,不良反应包括非血液学毒性和血液学毒性两方面,非血液学毒性包含消化道毒性如恶心呕吐,过敏反应如皮疹、面部潮红、周围神经毒性。血液学毒性包含白细胞减少、血小板减少、贫血。
1.4 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料用均数±标准差表示,两组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者化疗后总缓解率的比较
化疗4周期后,观察组患者的总缓解率高于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组患者化疗后总缓解率的比较(例)

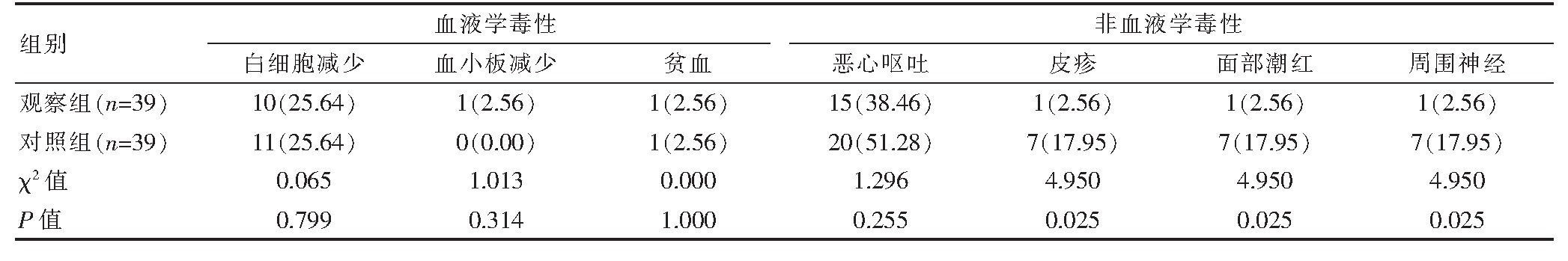
2.2 两组患者不良反应发生情况的比较
两组患者的血液学毒性发生率比较,差异无统计学意义(P>0.05);非血液学毒性方面,两组患者的恶心呕吐发生率比较,差异无统计学意义(P>0.05);观察组患者的皮疹、面部潮红和周围神经毒性发生率均低于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组患者不良反应发生情况的比较[n(%)]
3 讨论
化疗是鼻咽癌治疗的主要手段之一,紫杉醇联合顺铂(TP方案)主要作为鼻咽癌的辅助化疗,因其可以产生很高的活性氧水平,从而很好地抑制颈部转移瘤体积,增强化疗效果[4]。而局部复发晚期鼻咽癌患者的抢救治疗是临床常见的重大挑战,联合方案如紫杉醇联合顺铂和氟尿嘧啶(TPF方案)可作为不适合再次照射/手术的局部复发性鼻咽癌患者的一种有效方案[10],也可作为诱导化疗减少放疗靶区体积[11]。在局部晚期鼻咽癌中,同步放化疗中加入诱导化疗可改善预后,TP方案与TPF方案在无疾病进展生存期和总生存期方面无显着差异,但在Ⅲ~Ⅳ毒性反应方面,TPF方案发生率较高[12]。在晚期鼻咽癌患者中,TP方案也显示较好的临床疗效和安全性[13]。
紫杉醇是细胞毒性化疗药物,通过促进微管的形成和稳定,妨碍细胞有丝分裂从而产生抗肿瘤作用,可用于治疗各种鳞状组织癌。但普通紫杉醇注射液需要特殊辅料聚氧乙基代蓖麻油及无水乙醇,这与其过敏反应、周围神经病变、肝毒性和药物传递障碍有关。白蛋白结合型紫杉醇采用纳米技术使疏水性紫杉醇与白蛋白结合,无需使用有毒增溶剂增加水溶性,并且利用白蛋白天然的独特转运机制,使得紫杉醇更多地分布于肿瘤组织,达到更高的肿瘤细胞内浓度。目前白蛋白结合型紫杉醇已在临床用于乳腺癌、局部晚期/转移性非小细胞肺癌及转移性胰腺癌外鳞状组织癌的治疗[14]。同时Huang等[15]开展Ⅰ/Ⅱ期临床试验,评价了白蛋白结合型紫杉醇联合顺铂治疗转移性鼻咽癌的最大耐受剂量(260 mg/m2第1天;140 mg/m2第1天和第8天;100 mg/m2第1、8及15天),三组剂量在临床效果和安全性方案无显着差异。Ke等[16]开展了Ⅱ临床试验,对Ⅲ~Ⅳb期鼻咽癌患者在第1天和第22天给予白蛋白结合型紫杉醇(260 mg/m2)和顺铂(80 mg/m2)化疗,然后在第43天和第64天静脉注射顺铂(80 mg/m2),同时接受调强放疗,研究结果表明,白蛋白紫杉醇联合顺铂作为晚期鼻咽癌同步放疗的诱导化疗可发挥较好的临床效果。
综合上述分析,晚期复发鼻咽癌患者也可能从白蛋白紫杉醇联合铂类药物化方案中获益。但顺铂的常见毒副反应为肾毒性、耳毒性以及胃肠道反应,且需要大量的水化,患者往往难以耐受[17]。洛铂的剂量限制性毒性为血小板下降,紫杉醇类药物联合洛铂可能导致更为严重的血液学毒性,使得患者难以完成既定的化疗周期,从而影响疗效[18-19]。奈达铂是第二代铂类衍生物,与顺铂具有相似的抗肿瘤活性,且具有更少的神经毒性和胃肠道反应,患者可耐受[20-23]。
本研究观察和比较了白蛋白结合型紫杉醇与普通紫杉醇注射液分别联合奈达铂在晚期鼻咽癌患者治疗中的临床效果和安全性,结果显示,观察组患者的总缓解率高于对照组,差异有统计学意义(P<0.05)。在安全性方面,两组患者的血液学毒性发生率比较,差异无统计学意义(P>0.05);非血液学毒性方面,两组患者的恶心呕吐发生率比较,差异无统计学意义(P>0.05);观察组患者的皮疹、面部潮红和周围神经毒性发生率均低于对照组,差异有统计学意义(P<0.05)。提示白蛋白结合型紫杉醇联合奈达铂治疗晚期复发鼻咽癌可获得较好的临床效果和安全性。同时白蛋白结合型紫杉醇在使用前未行预处理,并未给予大剂量地塞米松预防过敏反应。
综上所述,白蛋白结合型紫杉醇联合奈达铂可以作为晚期复发鼻咽癌的一种化疗方案,临床效果确切,安全性好,且使用方便,不需要地塞米松预处理,适用于不能使用地塞米松的患者。但由于本研究观察样本数量有限,随访时间较短,可能存在一定的数据偏移,仍需要大量的试验数据验证。
参考文献
[1]Wei KR,Zheng RS,Zhang SW,et al.Nasopharyngeal carcinoma incidence and mortality in China,2013[J].Chin J Cancer,2017,36(1):90.
[2]Xu T,Zhou X,Shen C,et al.Suggestions for surveillance and radiation strategy in nasopharyngeal carcinoma treated with IMRT:Based on hazard-rate and patterns of recurrence[J].Oral Oncol,2018,76:61-67.
[3]Au E,Tan EH,Ang PT.Activity of paclitaxel by three-hour infusion in Asian patients with metastatic undifferentiated nasopharyngeal cancer[J].Ann Oncol,1998,9(3):327-329.
[4]Rhomdhoni AC,Kurniawan P,Hidayati T.Correlation Between Superoxide Dismutase Serum Level Alteration with Neck Metastatic Tumor Post Cisplatin-Paclitaxel Chemotherapy Response in Nasopharyngeal Carcinoma Patients[J].Indian J Otolaryngol Head Neck Surg,2019,71(Suppl 1):643-646.
[5]Li X,Kwon H.Efficacy and Safety of Nanoparticle AlbuminBound Paclitaxel in Elderly Patients with Metastatic Breast Cancer:A Meta-Analysis[J].J Clin Med,2019,8(10):1689.
[6]Kang Y,Shiraki E,Tsuyuki S.Efficacy and Safety of Nanoparticle Albumin-Bound Paclitaxel as Neoadjuvant Chemotherapy in Breast Cancer Patients[J].Gan To Kagaku Ryoho,2019,46(9):1427-1431.
[7]Asahina H,Oizumi S,Takamura K,et al.A prospective phaseⅡstudy of carboplatin and nab-paclitaxel in patients with advanced non-small cell lung cancer and concomitant interstitial lung disease(HOT1302)[J].Lung Cancer,2019,138:65-71.
[8]Jameson GS,Borazanci E,Babiker HM,et al.Response Rate Following Albumin-Bound Paclitaxel Plus Gemcitabine Plus Cisplatin Treatment Among Patients With Advanced Pancreatic Cancer:A Phase 1b/2 Pilot Clinical Trial[J].JAMA Oncol,2019,6(1):125-132.
[9]Specenier P.Efficacy of nab-paclitaxel in treating metastatic melanoma[J].Expert Opin Pharmacother,2019,20(5):495-500.
[10]Wang Y,Wang ZQ,Jiang YX,et al.A triplet chemotherapy regimen of cisplatin, fluorouracil and paclitaxel for locoregionally recurrent nasopharyngeal carcinoma cases contraindicated for re-irradiation/surgery[J].Expert Opin Pharmacother,2016,17(12):1585-1590.
[11]Xiang ZZ,Liu F,Yan RN,et al.The prognostic value of volumetric reduction of the target lesions after induction chemotherapy in locoregionally advanced nasopharyngeal carcinoma[J].Head Neck,2019,41(6):1863-1872.
[12]Lokesh KN,Chaudhuri T,Lakshmaiah KC,et al.Induction chemotherapy in locoregionally advanced nasopharyngeal carcinoma in adults:Results from a nonendemic region[J].Indian J Cancer,2018,55(3):257-260.
[13]Wu F,Wu LL,Chen GF,et al.Retrospective study on the efficacy of different chemotherapy regimens concurrently combined with intensity modulated radiation therapy in treatment ofⅢ-Ⅳa stage nasopharyngeal carcinoma[J].Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2016,30(19):1536-1539.
[14]Loong HH,Chan AC,Wong AC.Evolving Evidence of the Efficacy and Safety of nab-Paclitaxel in the Treatment of Cancers with Squamous Histologies[J].J Cancer,2016,7(3):268-275.
[15]Huang Y,Liang W,Yang Y,et al.PhaseⅠ/ⅡDose-Finding Study of Nanoparticle Albumin-Bound Paclitaxel(nabRPaclitaxel)Plus Cisplatin as Treatment for Metastatic Nasopharyngeal Carcinoma[J].BMC Cancer,2016,16:464.
[16]Ke LR,Xia WX,Qiu WZ,et al.A phaseⅡtrial of induction NAB-paclitaxel and cisplatin followed by concurrent chemoradiotherapy in patients with locally advanced nasopharyngeal carcinoma[J].Oral Oncol,2017,70:7-13.
[17]吴菲,薛蔚洁,施怡芳,等.培美曲塞联合顺铂治疗晚期非小细胞肺癌的疗效分析[J].肿瘤药学,2017,7(5):576-580.
[18]钱树苑,黄小冰,李睿,等.洛铂与顺铂联合吉西他滨用于晚期肺癌患者化疗的疗效比较[J].现代生物医学进展,2016,16(29):5709-5712.
[19]詹德超,陈梓宏,温继育,等.多西紫杉醇在局部晚期鼻咽癌奈达铂同期放化疗中联合使用的临床效果观察[J].中国医药科学,2018,8(6):198-200.
[20]邱模军,汪晓梅,肖玉清.顺铂与奈达铂同期放化疗结合胎盘多肽注射液治疗晚期复发性鼻咽癌的效果分析[J].中国当代医药,2019,26(29):58-61.
[21]胡利兵.奈达铂联合氟尿嘧啶对食管癌患者肺功能及炎症细胞因子的影响[J].中国医学创新,2019,16(15):113-116.
[22]刘同欣,孙权权,陈晶,等.多西他赛联合奈达铂在局部晚期鼻咽癌中的近远期疗效、安全性及预后分析[J].中国医药导报,2019,16(23):150-155.
[23]Peng H,Tang LL,Chen BB,et al.Optimizing the induction chemotherapy regimen for patients with locoregionally advanced nasopharyngeal carcinoma:A big-data intelligence platform-based analysis[J].Oral Oncol,2018,79:40-46.

