新型胃癌筛查评分系统临床应用研究
摘要:目的 探讨新型胃癌筛查评分系统在胃癌筛查中的应用价值。方法 兰州大学第二医院内镜团队在2018年4—12月,依据“中国早期胃癌筛查流程专家共识意见(草案),(2017,上海)”纳入筛查人群451名,开展问卷调查,检测胃蛋白酶原I(PGI)、胃蛋白酶原II(PGII)值、(PGI)/PGII及胃泌素17(G17)水平,幽门螺旋杆菌(Hp)感染阳性率,根据新型评分系统将筛查人群分为低、中、高危组。所有患者进行胃镜检查并对内镜下发现的可疑病灶进行活检+病理诊断。结果 PGI、PGI/PGII水平,低危组>中危组>高危组;PGII、G17水平,低危组<中危组<高危组。Hp总感染率60.75%,低危组为33.33%;中危组为50.77%;高危组为60.00%,呈上升趋势。低危组发现11例低级别上皮内瘤变(LGIN);中危组发现腺癌1例,高级别上皮内瘤变(HGIN)4例,LGIN23例,胃癌检出率3.8%;高危组发现HGIN2例,LGIN9例,胃癌检出率13.3%。结论:新型胃癌筛查评分系统可以有效的提高胃癌检出率,避免了医疗资源的浪费。
关键词:胃癌筛查评分系统; 高级别上皮内瘤变; 低级别上皮内瘤变; 胃蛋白酶原; 胃泌素; 幽门螺旋杆菌;
胃癌是指起源于胃黏膜上皮的恶性肿瘤,好发于50岁人群中,且男性发病率略高于女性[2-3]。胃癌发病机制尚未完全明确,多数患者确诊时已经是中晚期,丧失最佳诊疗时机[4-5]。目前,临床上对于胃癌筛查多以胃镜检查+病理组织检查为主,虽然能帮助患者确诊,但是检查风险性、创伤性较高,并且检查可重复性较差,患者不易接受,大规模筛查存在医疗资源浪费、普及困难等缺点。血清胃蛋白酶原(PG)、胃泌素17(G17)均源于胃部,其表达水平的高低能间接的反映不同部位胃黏膜的分泌功能及组织状态[6-7]。我国胃镜检查联合以上指标用于胃癌筛查中的应用研究较少。且大规模人群的胃镜检查+病理活检的筛查方式存在医疗资源浪费,实施困难等问题。有报道自2007年以来,日本等国家应用“ABC”法,对胃癌高危人群进行危险度分层,针对不同危险分层对象实施不同间隔时间段的胃镜检查+病理检查,并且取得了一定的效果[8-9]。2017年我国消化专业医学专家联合制定了《中国早期胃癌筛查流程专家共识意见(2017年,上海)》,该共识意见提出了我国首个胃癌筛查评分系统。本研究旨在胃癌筛查实践中对新型胃癌筛查评分系统作进一步评价。
1 资料与方法
1.1 临床资料
2018年4月至2018年12月在兰州大学第二医院消化内镜团队以“中国早期胃癌筛查流程专家共识意见(草案),(2017,上海)”中提出的胃癌筛查要求设置纳入标准:年龄≥40岁,且符合下列任意一条者,建议其作为胃癌筛查对象:(1)胃癌高发地区人群;(2)幽门螺杆菌(Hp)感染者;(3)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃的癌前疾病;(4)胃癌患者一级亲属;(5)存在胃癌其他风险因素(如摄入高盐、腌制饮食、吸烟、重度饮酒等)。排除标准:(1)有严重的心、肺功能不全,或精神疾患;(2)胃部手术史(外科手术);(3)正在使用或就诊前两周内使用PPI、制酸剂、护胃剂等;(4)正在服用阿司匹林、华法林等抗凝药者,或存在凝血功能障碍者。通过现场问卷调查,共筛选451例门诊无症状人群作为筛查对象。本研究经本院医学伦理委员会讨论批准,所有患者均自愿签署知情同意书。
1.2 筛查方法
(1)标本采集:所有筛查患者早晨取空腹静脉血3 mL,3000 r/min,15 min离心;血清分离后放置在-80℃冰箱中,备用。(2)PG、G17检测方法:PG试剂盒采用基于时间分辨荧光免疫分析(TRFIA)的荧光微球层析免疫分析技术,采用荧光微球标记示踪双抗体夹心免疫分析法定量检测人血浆中PG的浓度;采用酶联免疫吸附试验完成血清G17水平检测;(3)幽门螺杆菌(Hp)测定:采用13C尿素呼气试验进行检测,试剂盒规格:每份试剂盒包括一瓶试剂(含50 mg的13C尿素)、两个采气气袋和两个标签。检测前禁食水8 h,让受试者口服13C标记的尿素后,通过13C-红外光谱仪来检测呼气中的13CO2含量变化,诊断Hp的感染。(4)胃镜及病理检查:使用奥林巴斯GIF-290型高清胃镜进行胃镜检查,必要时结合放大内镜及窄带成像(ME-NBI)进行评判,并且对疑似病灶进行活检取样,进行病理诊断,病理诊断分别为萎缩性胃炎(AG)、低级别上皮内瘤变(LGIN)、高级别上皮内瘤变(HGIN)、胃癌(gastric carcinoma,GC)。
1.3 统计分析
采用SPSS22.0软件处理,计数资料采用例(%)表示,率的比较用卡方检验,率的变化用卡方趋势检验,计量资料采用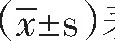 表示,多组间均数比较用F检验和LSD检验,P<0.05为差异有统计学意义。
表示,多组间均数比较用F检验和LSD检验,P<0.05为差异有统计学意义。
2 结果
收集所有筛查对象的检查数据,根据共识意见中提出的评分标准,分为低危组(306例)、中危组(130例)和高危组(15例)。低危组男性177例,女性129例,年龄(41~69)岁,平均(45.22±6.89)岁;中危组男性72例,女性58例,年龄(40~74)岁,平均(48.13±7.13)岁;高危组15例均为男性,年龄(51~77)岁,平均(50.50±7.36)岁。各组年龄比较P=0.004,差异有统计学意义。
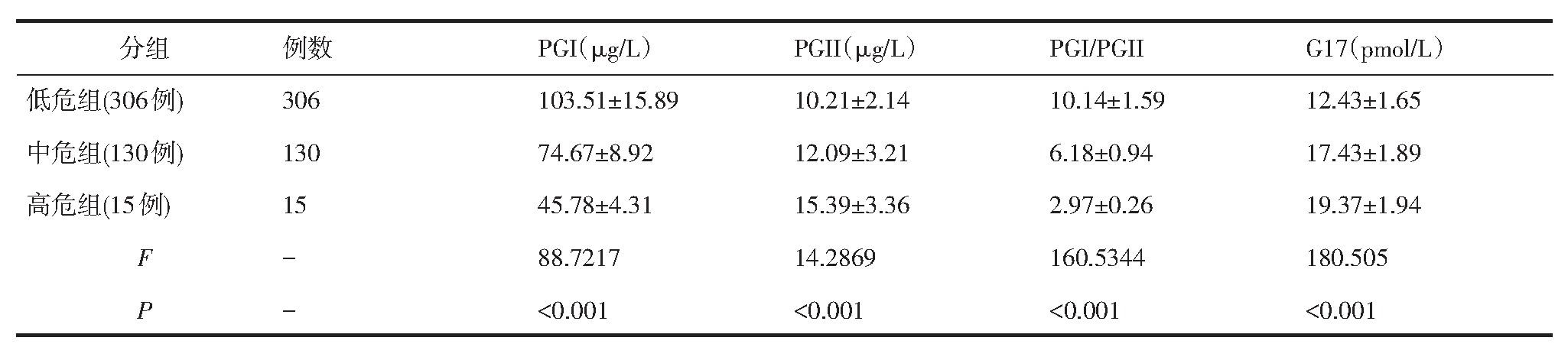
低危组PGI、PGI/PGII水平,均高于中危组和高危组(P<0.001);中危组PGI、PGI/PGII水平,均高于高危组(P<0.001);低危组PGII、G17水平,低于中危组和高危组(P<0.001);中危组PGII、G17水平,低于高危组(P<0.05)(见表1)。
表1 三组患者PGI、PGII值、PGI/PGII及G17水平结果及统计比较
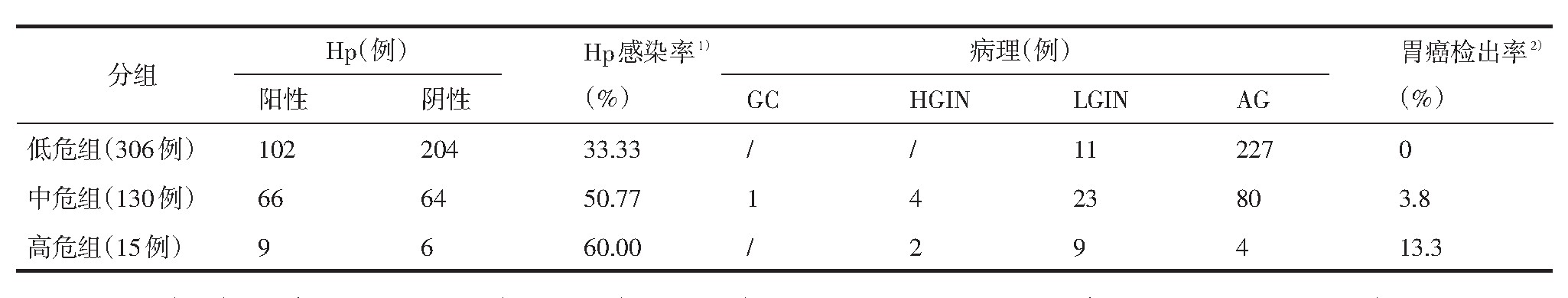
 胃镜及病理检查结果:低危组发现11例低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN);中危组发现中分化腺癌(进展期)1例,高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)4例,LGIN23例,胃癌检出率3.8%;高危组发现HGIN2例,LGIN9例,胃癌检出率13.3%。筛查对象Hp总的感染率60.75%,其中低危组为33.33%;中危组为50.77%;高危组为60%,呈上升趋势(见表2)。
胃镜及病理检查结果:低危组发现11例低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN);中危组发现中分化腺癌(进展期)1例,高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)4例,LGIN23例,胃癌检出率3.8%;高危组发现HGIN2例,LGIN9例,胃癌检出率13.3%。筛查对象Hp总的感染率60.75%,其中低危组为33.33%;中危组为50.77%;高危组为60%,呈上升趋势(见表2)。
表2 幽门螺杆菌检测及病理检查结果
3 讨论
胃癌的发生、发展是一个多因素相互作用的过程,现阶段对于早期胃癌的诊断仍然缺乏合适的生物标志物。近年来,PG、G17、HP感染联合胃镜检查在胃癌筛查中得到广泛应用,且效果理想[10-11]。由于非萎缩性胃炎患者并无胃癌患病风险,萎缩性胃炎与胃癌风险增加相关[12]。胃蛋白酶原水平可以较好的预测胃黏膜是否发生萎缩,其属于天冬氨酸蛋白家族成员,主要由胃主细胞合成、分泌,且由PGI于PGII 2个不同的亚群构成。PG在Hp感染时可能升高;血清PGII水平可区分胃炎黏膜和正常黏膜,但对胃癌鉴别并不特异[13]。并且当胃黏膜腺体发生萎缩后,PGI分泌水平将会减少,而当胃黏膜腺体发生肠上皮化生或假幽门腺化生时PGII水平则会增加[14-15]。由于Hp感染状态,胃黏膜是否发生萎缩、肠化等诸多因素都会影响胃蛋白酶原的表达水平,PG表达水平在只能在一定程度上认为是胃癌发生的预测指标。G17是一种胃肠激素,有助于调节患者消化道功能[16]。目前认为,高胃泌素血症与胃神经内分泌肿瘤和胃腺癌的发展有关,动物和人体研究均显示胃泌素水平升高的患者胃癌发病率更高[17]。G17能参与胃癌的发生、发展,其水平测定可以作为胃癌筛查的一项指标[18]。本研究中,PGI、PGI/PGII水平在低、中、高危组中逐步降低(P<0.001);而PGII、G17水平逐步升高(P<0.001)。
Hp感染可能在早期胃癌的发生、发展过程中起到了重要作用;临床研究表明:Hp引起的感染不仅能引起消化性溃疡、炎症,亦可影响PG的合成与分泌,是引起胃癌的重要原因。Hp感染还可以促进细胞死亡并使感染的上皮细胞更新减慢引起细胞应激适应机制的改变从导致正常黏膜转变为慢性浅表性胃炎,并逐渐进展为萎缩性胃炎,肠上皮化生,最后进展为不典型增生和腺癌。本研究中,451名筛查对象Hp检测阳性达274例,阳性率为60.75%;在不同级别危险度分组中,Hp感染率呈逐步上升趋势。但在新型胃癌筛查评分系统中有无Hp感染所占分值只有1分,所占比率远远低于其他指标。因此我们提出Hp感染在新型评分系统中的所占比例有待进一步大样本筛查过程中进行评价分析。
同时胃癌家族史也是胃癌发生的一项危险因素,有一级亲属被诊断为胃癌是一种强烈而持续的危险因素,虽然其家族聚集的致病机制尚不清楚[19]。在本次筛查中,中危组存在1例中分化腺癌进展期患者,该患者男性,62岁,父母已故,其兄2年前因胃恶性肿瘤去世。虽然该病例在此次筛查分析中无统计学意义,但胃癌家族史是否也纳入到新型评分系统有待进一步观察总结。
日本学者提出的“ABC”法系统的分析了胃内相关腺体、细胞的功能,结合Hp感染情况,用于胃癌罹患的危险分层分析,应用简便,首次应用于大规模早期胃癌的筛查。但该种方法中胃蛋白酶原水平较易受其他因素影响,且分组组合较为复杂,没有具体量化指标,临床应用存在不足。此次我国提出的新型评分系统基于15000余例多中心大样本分析,并且加入了G17水平检测,综合了年龄、性别等因素影响,对风险因素进行量化,评估更加准确,有助于临床对危险人群进行进一步分组,大大减少了胃癌筛查的工作量,节省医疗资源,提高了筛查效率,减少了反复患者胃镜检查的痛苦。本研究中根据胃镜及病理检查结果显示,在低、中、高危不同分组中,胃癌检出率逐步升高,可以看出应用新型胃癌筛查评分系统对筛查人群具备更高的靶向分组准确性,可以更有效地指导不同人群进行胃镜及病理检查。但新型评分系统对于胃癌家族史、Hp感染等胃癌高危因素是否需要进一步完善,有待临床更进一步观察完善。
参考文献
[1]杜奕奇,蔡全才,廖专,等.中国早期胃癌筛查流程专家共识意见(草案)(2017年,上海)[J].胃肠病学, 2018, 23(2):92-97.
[2]刘应玲,陈思,洪海鸥,等.血清胃蛋白酶原、胃泌素17和幽门螺杆菌检测在胃癌前病变诊断中的价值[J].安徽医科大学学报,2017,52(8):1227-1231.
[3]Akutsu T,Saito H,Iwase H,et al. The applicability of ELISA detection of gastric mucosa-expressing proteins for the identification of vomit[J]. Int J Legal Med,2017,131(2):359-364.
[4]刘德地,张磊,王亚雷,等.血清胃蛋白酶原、促胃液素-17和幽门螺杆菌抗体对胃癌前状态筛查能力的评价[J].安徽医科大学学报,2017,52(10):1563-1567.
[5]Chen XZ,Huang CZ,Hu WX,et al. Gastric cancer Screening by combined determination of serum Helicobacter pylori antibody and pepsinogen concentrations:ABC method for gastric cancer screening:[J]. Chin Med J,2018,131(10):1232-1239.
[6]谭银利,陈和安,刘飞.外周血胃蛋白酶原Ⅰ与胃泌素-17及可溶性人白细胞抗原-G检测对胃癌的诊断价值[J].中国临床药理学杂志,2017,33(10):945-947.
[7] Tu H,Sun L,Dong X,et al. A serological biopsy using five stomach-specific circulating biomarkers for gastric cancer risk assessment:a multi-phase study[J]. Ame J of Gastroenterol,2017,112(5):704.
[8]Kudo T, Kakizaki S, Sohara N, et al. Analysis of ABC(D)stratification for screening patients with gastric cancer[J]. World J Gastroenterol, 2011, 17(43):4793-8.
[9]Miki K. Gastric cancer screening by combined assay for serum antiHelicobacter pylori IgG antibody and serum pepsinogen levels-“ABC method”[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2011, 87(7):405-414.
[10]Zagari RM,Rabitti S,Greenwood DC,et al. Systematic review with meta-analysis:diagnostic performance of the combination of pepsinogen,gastrin-17 and anti-Helicobacter pylori antibodies serum assays for the diagnosis of atrophic gastritis[J]. Alimentary Pharmacol Therap,2017,46(7):657.
[11]陆兴热,陈凤羽,杨德兴,等.MIC-1、G17及PG1对胃癌诊断价值及感染病原菌的影响研究[J].中国现代医学杂志,2016,26(24):47-50.
[12]Genta RM, Rugge M. Assessing risks for gastric cancer:new tools for pathologists[J]. World J Gastroenterol, 2006, 12:5622-5627.
[13]Haj-Sheykholeslami A, Rakhshani N, Amirzargar A, et al. Serum pepsinogen I, pepsinogen II, and gastrin 17 in relatives of gastric cancer patients:comparative study with type and severity of gastritis[J]. Clin Gastroenterol Hepatol, 2008, 6:174-179.
[14]张爱军,严姣华,陶京,等.老年患者胃切除消化道重建病原菌感染及对细胞外基质降解与重构的影响研究[J].中华医院感染学杂志,2016,26(1):109-111.
[15]Kucera R,Smid D,Topolcan O,et al. Searching for new biomarkers and the use of multivariate analysis in gastric cancer diagnostics[J].Anticancer Res,2016,36(4):1967.
[16]Pritchard DM,Hooper M. Letter:gastric cancer and pernicious anaemia-only a minority of UK pernicious anaemia patients have had a gastroscopy[J]. Alimentary Pharmacol Therap,2016,43(10):1106-1107.
[17]Waldum HL, Sagatun L, Mjones P. Gastrin and gastric cancer[J].Frontiers Endocrinol, 2017, 8:1.
[18]Kurilovich S,Belkovets A,Reshetnikov O,et al. Stomach-specific Biomarkers(GastroPanel)Can Predict the Development of Gastric Cancer in a Caucasian Population:A Longitudinal Nested Case-Control Study in Siberia[J]. Anticancer Research,2016,36(1):247-253.
[19]Choi YJ, Kim N. Gastric cancer and family history[J]. Korean J Intern Med, 2016, 31(6):1042-1053.
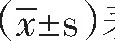 表示,多组间均数比较用F检验和LSD检验,P<0.05为差异有统计学意义。
表示,多组间均数比较用F检验和LSD检验,P<0.05为差异有统计学意义。

