不同口服药物治疗出生胎龄<28周有血流动力学意义动脉导管未闭超早产儿的疗效与安全性
摘 要:目的 探讨口服布洛芬与对乙酰氨基酚治疗有血流动力学意义动脉导管未闭(hsPDA)超早产儿(出生胎龄<28周)的疗效及安全性。方法 选择2012年11月至2019年10月,上海市第一妇婴保健院收治的符合本研究纳入与排除标准的96例hsPDA超早产儿为研究对象。根据采取的口服药物治疗方案,将其分为布洛芬组(n=53)与对乙酰氨基酚组(n=43)。2组患儿达到全肠道喂养时间、有创机械通气时间及口服药物治疗前、后动脉导管内径比较,采用成组t检验。2组患儿接受口服药物治疗后,动脉导管关闭率、并发症发生率、口服药物治疗失败后中转手术治疗率及患儿病死率比较,采用χ2检验或Fisher确切概率法。2组患儿性别构成比、出生胎龄、出生体重,生后1、5 min Apgar评分,肺表面活性物质使用率、接受口服药物治疗时日龄,以及母亲产前地塞米松促胎肺成熟治疗率、剖宫产术分娩率、胎膜早破持续时间>18 h所占比例等一般临床资料比较,差异均无统计学意义(P>0.05)。本研究遵循的程序符合2013年新修订的《世界医学协会赫尔辛基宣言》要求。结果 (1)布洛芬组患儿动脉导管关闭率为56.6%(30/53),显著高于对乙酰氨基酚组的30.2%(13/43),并且差异有统计学意义(χ2=6.676、P=0.009)。接受口服药物治疗后,布洛芬组患儿动脉导管内径为(0.14±0.26) cm,显著小于对乙酰氨基酚组的(0.30±0.14) cm,并且差异有统计学意义(t=-5.406、P=0.007)。(2)2组患儿达到全肠道喂养时间及有创机械通气时间分别比较,差异均无统计学意义(P>0.05)。(3)2组患儿肝、肾功能损害及高胆红素血症、血小板减少、贫血、胃肠道出血、肺出血、脑室内出血(IVH)、早发型败血症(EOS)、晚发型败血症(LOS)、支气管肺发育不良(BPD)、坏死性小肠结肠炎(NEC)、早产儿视网膜病变(ROP)发生率,以及口服药物治疗失败后中转手术治疗率、患儿病死率分别比较,差异均无统计学意义(P>0.05)。结论 布洛芬治疗hsPDA超早产儿的安全性与对乙酰氨基酚相似,但是其治疗疗效,显著高于对乙酰氨基酚。由于本研究仅为单中心研究,纳入样本量相对较小,因此布洛芬与对乙酰氨基酚治疗hsPDA超早产儿的疗效及安全性比较,尚需大样本、多中心、随机对照试验进一步研究、证实。
关键词:布洛芬 对乙酰氨基酚 动脉导管未闭 血流动力学 婴儿,早产
动脉导管未闭(patent ductus arteriosis,PDA)是指出生后,动脉导管持续开放>72 h,是早产儿常见疾病。目前国际上将血流动力学改变显著,出现相应临床表现,并且可能发生一系列并发症的PDA,称为有血流动力学意义PDA(hemodynamically significant patent ductus arteriosus,hsPDA)[1-4]。随着医疗条件改善及医疗技术提高,越来越多早产儿,尤其是超早产儿(出生胎龄<28周)得以成活。hsPDA作为早产儿常见合并症,愈来愈引起临床重视。非甾体类抗感染药物是目前临床治疗hsPDA早产儿的首选方法,最初多采用布洛芬和吲哚美辛治疗,但是吲哚美辛导致的并发症较多[1-2],中国国家药品监督管理局明确指出14岁以下儿童不宜使用吲哚美辛。近年较多研究比较对乙酰氨基酚和布洛芬治疗hsPDA早产儿的疗效,认为对乙酰氨基酚是关闭动脉导管的替代药物[3,5],但是研究结果不尽相同[4],并且对超早产儿研究较少。本研究拟探讨口服对乙酰氨基酚和布洛芬治疗hsPDA早产儿的疗效及安全性,为临床治疗该类患儿提供参考,从而提高我国早产儿服务保健水平。现将研究结果报道如下。
1 资料与方法
1.1 研究对象及分组
2012年11月至2019年10月,上海市第一妇婴保健院收治的出生胎龄<28周hsPDA超早产儿为294例,其中21例患儿于出生后1周内死亡,18例患儿家属放弃治疗,10例合并其他严重心脏畸形,12例合并布洛芬或对乙酰氨基酚治疗禁忌证,67例患儿母亲产前使用吲哚美辛,70例生后未使用布洛芬、对乙酰氨基酚治疗而被排除。最终,选取符合本研究纳入与排除标准的96例hsPDA超早产儿为研究对象。根据采取的口服药物治疗方案,将其分为布洛芬组(n=53)与对乙酰氨基酚组(n=43)。本研究遵循的程序符合2013年新修订的《世界医学协会赫尔辛基宣言》要求。
1.2 方法
1.2.1 hsPDA患儿诊断标准
hsPDA患儿诊断标准:出生后动脉导管持续开放>72 h,并且其临床表现与心脏超声结果出现以下任意一项者,即可被诊断为hsPDA[2,5-6]。其中,临床表现包括:心率持续>160 次/min、收缩期杂音、脉压>25 mmHg(1 mmHg=0.133 kPa)、肝大、脾大、皮肤发花、喂养不耐受、胸部X射线摄片检查显示肺血增多者[5]。心脏超声结果包括:动脉导管内径≥1.5 mm,大动脉短轴切面左心房收缩期前、后径与主动脉根部内径比值≥1.4,动脉导管左向右分流速率<2.0 m/s,降主动脉舒张期血流消失或反转[2,6]。
1.2.2 纳入与排除标准
本研究纳入标准:①出生胎龄<28周的超早产儿;②符合hsPDA诊断标准[2,5-6]者;③采取布洛芬或对乙酰氨基酚治疗的hsPDA超早产儿。排除标准:①合并其他严重心脏畸形,如室间隔缺损、法洛四联症、肺动脉闭锁、大动脉转位等的患儿;②合并其他严重先天畸形,如消化道畸形、21-三体综合征等疾病者;③合并胃肠道出血,坏死性小肠结肠炎(necrotizing enterocolitis,NEC)活动期或其他需要禁食症状,而无法进行胃肠道喂养者;④合并布洛芬或对乙酰氨基酚治疗禁忌证者,如高胆红素血症达到换血标准、血清肌酐浓度>88.4 μmol/L、血小板计数<50×109/L,以及中度或重度(Ⅲ级以上)脑室内出血(intraventricular hemorrhages,IVH)等;⑤纳入研究前有布洛芬、乙酰氨基酚或环氧化酶抑制剂治疗史者;⑥有葡萄糖-6-磷酸脱氢酶缺陷病家族史者;⑦出生后1周内死亡者;⑧患儿家属要求放弃治疗者。
1.2.3 hsPDA超早产儿治疗方案
2组患儿的治疗方案:布洛芬组口服布洛芬混悬滴剂(规格:15 mL∶0.6 g,批号:190413198,上海强生制药有限公司),第1天口服剂量为10 mg/(kg·d),第2~3天为5 mg/(kg·d),共计治疗3 d;对乙酰氨基酚组患儿口服对乙酰氨基酚混悬滴剂(规格:15 mL∶1.5 g,批号:160106011,上海强生制药有限公司),剂量为15 mg/(kg·6 h),共计治疗3 d。2组患儿治疗完成后,再次进行心脏超声检查,观察动脉导管是否关闭。
1.2.4 观察指标
①2组患儿及其母亲一般临床资料:患儿出生胎龄、出生体重、性别、Apgar评分、接受口服药物治疗时日龄等,其母亲围生期情况,如产前是否使用糖皮质激素和MgSO4、是否发生胎膜早破、胎膜早破持续时间>18 h例数、分娩方式(自然分娩或剖宫产术分娩)。②达到全肠道喂养时间和有创机械通气时间。③患儿相关实验室检查结果:接受口服药物治疗前、后1周内心脏超声检查结果,包括动脉导管内径,左心房收缩期前、后径与主动脉根部内径比值,以及血常规与肝、肾功能结果等。④患儿动脉导管关闭率。⑤患儿治疗相关并发症发生率及预后情况:NEC分期(根据Bell分类标准),支气管肺发育不良(bronchopulmonary dysplasia,BPD),IVH,早产儿视网膜病变(retinopathy of prematurity,ROP),早发型败血症(early-onset sepsis,EOS),晚发型败血症(late-onset sepsis,LOS),以及胃肠道出血、肺出血、死亡等发生率。
1.3 统计学分析方法
本研究所有数据采用SPSS 17.0统计学软件包处理。采用Ssize软件,确定满足本研究统计检验的最小样本量。对于呈正态分布的计量资料,如患儿出生胎龄、生后1与5 min Apgar评分、接受口服药物治疗时日龄、达到全肠道喂养时间、有创机械通气时间,以及治疗前、后动脉导管内径,左心房收缩期前、后径与主动脉根部内径比值等,采用x¯±s表示,2组比较,采用成组t检验。对于计数资料,如患儿性别构成比、动脉导管关闭率、治疗相关并发症发生率等,采用百分比(%)表示,2组比较采用χ2检验或Fisher确切概率法。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 2组患儿一般临床资料比较
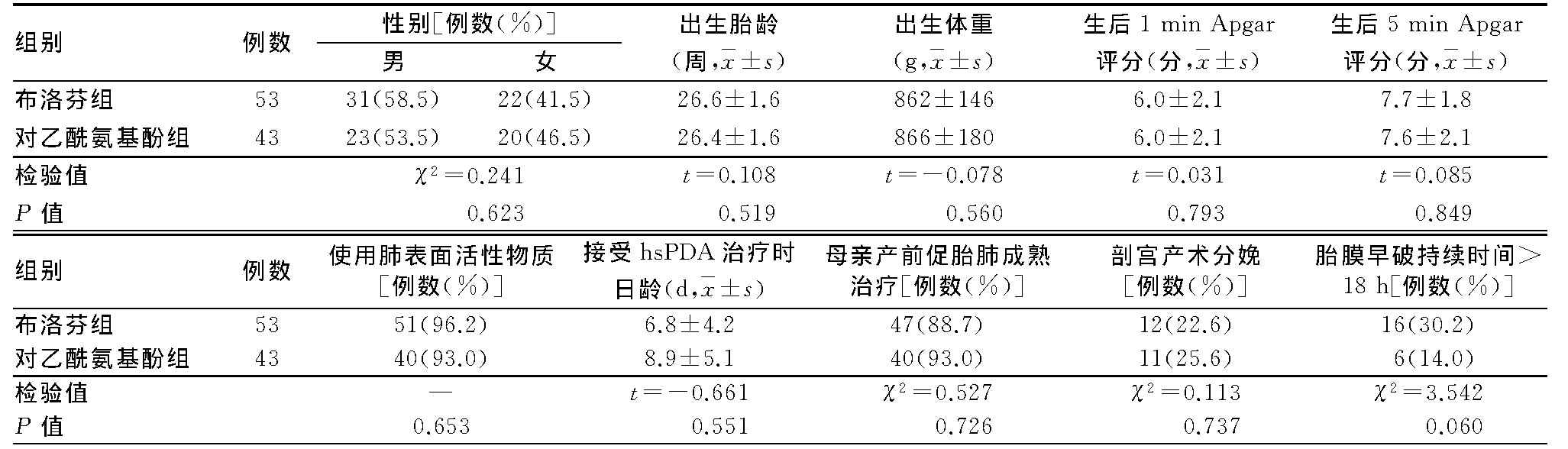
2组患儿的性别构成比、出生胎龄、出生体重,生后1、5 min Apgar评分,肺表面活性物质使用率、接受口服药物治疗时日龄,以及母亲产前使用地塞米松促胎肺成熟治疗率、剖宫产术分娩率、胎膜早破持续时间>18 h所占比例等一般临床资料比较,差异均无统计学意义(P>0.05)。2组患儿及其母亲相关临床资料比较,见表1。
表1 2组患儿及其母亲相关临床资料比较
2.2 2组患儿治疗疗效及达到全肠道喂养时间与有创机械通气时间比较
布洛芬组患儿动脉导管关闭率,显著高于对乙酰氨基酚组,2组比较,差异有统计学意义(P<0.05)。2组患儿接受口服药物治疗前动脉导管内径比较,差异无统计学意义(P>0.05),而接受口服药物治疗后,布洛芬组动脉导管内径,显著小于对乙酰氨基酚组,并且差异有统计学意义(P<0.05)。2组患儿左心房收缩期前、后径与主动脉根部内径比值在接受口服药物治疗前、后分别比较,差异均无统计学意义(P>0.05)。2组患儿达到全肠道喂养时间与有创机械通气时间分别比较,差异均无统计学意义(P>0.05)。2组患儿治疗疗效及达到全肠道喂养时间与有创机械通气时间比较,见表2。
表2 2组患儿治疗疗效及达到全肠道喂养时间与有创机械通气时间比较
组别 例数 动脉导管关闭
[例数(%)]
动脉导管内径(cm,x¯±s)
左心房收缩期前、后径与主动
脉根部内径比值(x¯±s) 达到全肠道
喂养时间
(d,x¯±s)
有创机械通气
时间(d,x¯±s)
治疗前 治疗后
治疗前 治疗后
布洛芬组 53 30(56.6) 0.34±0.08 0.14±0.26 1.07±0.12 1.06±0.15 38.0±12.0 20.9±16.3
对乙酰氨基酚组 43 13(30.2) 0.38±0.11 0.30±0.14 1.16±0.05 0.79±0.37 30.9±13.4 24.8±3.5
检验值 χ2=6.676 t=-1.414 t=-5.406 t=-1.754 t=-2.059 t=0.463 t=-0.461
P值 0.009 0.969 0.007 0.073 0.114 0.517 0.525
2.3 2组患儿治疗相关并发症发生率及其预后情况比较
2组患儿肝、肾功能损害及高胆红素血症、血小板减少、贫血、胃肠道出血、肺出血、IVH、EOS、LOS、BPD、NEC、ROP发生率,以及口服药物治疗失败后中转手术治疗率、患儿病死率分别比较,差异均无统计学意义(P>0.05)。2组患儿治疗相关并发症及预后情况比较,见表3。
表3 2组患儿治疗相关并发症及预后情况比较[例数(%)]
组别 例数 肝功能损害 肾功能损害 高胆红素血症 血小板减少 贫血 胃肠道出血 肺出血 IVH
布洛芬组 53 1(1.9) 2(3.8) 1(1.9) 1(1.9) 10(18.9) 5(9.4) 9(17.0) 10(18.9)
对乙酰氨基酚组 43 1(2.3) 0(0) 0(0) 0(0) 6(14.0) 3(7.0) 9(20.9) 14(32.6)
χ2值 - - - - 0.412 - 0.243 2.373
P值 1.000 0.500 1.000 1.000 0.520 0.665 0.622 0.123
组别 例数 EOS LOS BPD NEC ROP 手术治疗a 病死率
布洛芬组 53 3(5.7) 3(5.7) 40(75.5) 2(3.8) 3(5.7) 4(7.5) 4(7.5)
对乙酰氨基酚组 43 6(14.0) 3(7.0) 31(72.1) 0(0) 0(0) 6(14.0) 0(0)
χ2值 - - 0.140 - - - -
P值 0.290 1.000 0.707 0.500 0.250 0.335 0.125
3 讨论
动脉导管连接于主动脉弓降部和肺动脉分叉处(近左肺动脉)的胎儿循环的正常通道[7]。胎儿期动脉导管内血液从肺动脉流向降主动脉,出生后,氧分压升高及前列腺素水平降低,可使动脉导管收缩,而引起动脉导管功能性关闭[8]。早产儿由于机体功能尚未发育成熟,其激活血管收缩能力低,并且血管重塑能力较差,若罹患呼吸系统疾病,则可导致动脉血氧含量下降、前列腺素受体下降等,而导致hsPDA发生,引发血流从压力较高的主动脉流向压力较低的肺动脉,从而导致肺充血及肺水肿,减少肾脏、肠系膜、脑血流灌注,诱发充血性心力衰竭、BPD[8-9]、IVH[10]和NEC[11-12]等并发症。若肺动脉压力超过主动脉压力,可引起动脉导管右向左分流,引起患儿明显的低氧血症和酸中毒[13]。
hsPDA可通过药物、手术或介入等治疗,而使动脉导管关闭[14]。由于口服药物治疗的疗效和安全性均较好,而成为目前临床治疗hsPDA早产儿的首选方法[15]。临床治疗hsPDA早产儿的口服药物主要包括非甾体类抗感染药物,如吲哚美辛、布洛芬等,其主要作用机制为通过抑制环氧化酶-1抑制机体合成前列腺素,降低血液前列腺素水平,进而促进动脉导管弹力层平滑肌收缩,同时提高肺动脉压,减少主-肺动脉间压差及分流,促进动脉导管闭合[15]。但是,非甾体类抗感染药物可竞争性抑制环氧化酶花生四烯酸,其作用受内源性花生四烯酸影响,并可导致血小板凝聚障碍、高胆红素血症、外周血管收缩及器官血流减少,从而导致肾功能损害及胃肠道穿孔等[16]。对乙酰氨基酚主要是通过抑制前列腺素E2的过氧化物酶,从而抑制环氧化酶[16],相对于非甾体类抗感染药物依赖内源性花生四烯酸,对乙酰氨基酚在较低浓度下即可抑制前列腺素合成[17],并且主要通过抑制中枢神经系统前列腺素合成,而发挥关闭动脉导管作用,同时其抑制外周血管收缩作用弱,故对乙酰氨基酚不引起环氧化酶抑制剂-1所致的消化道出血、血小板减少、少尿等不良反应[17]。
本研究结果显示,布洛芬组患儿的动脉导管关闭率,显著高于对乙酰氨基酚组,并且差异有统计学意义(P<0.05)。这可能与本研究纳入的超早产儿与其他研究纳入的患儿相比,出生胎龄更小及出生体重更低的缘故。因为,口服布洛芬和对乙酰氨基酚治疗hsPDA超早产儿与hsPDA较大胎龄儿的作用机制不同[4],而且对乙酰氨基酚对外周血管收缩作用,较布洛芬弱[4]。
对于口服药物治疗hsPDA早产儿的不良反应和治疗相关并发症发生情况的既往研究表明,对乙酰氨基酚治疗导致的肝、肾功能损害,胆红素水平增高及血小板降低等不良反应发生率,较布洛芬更低[18]。但是,本研究结果表明,对乙酰氨基酚组与布洛芬组患儿治疗相关肝功能损害、肾功能损害、高胆红素血症、血小板减少、贫血、胃肠道出血、肺出血、IVH、EOS、LOS、BPD、NEC、ROP等不良反应发生率,以及口服药物治疗失败后中转手术治疗率、患儿病死率分别比较,差异均无统计学意义(P>0.05);2组患儿达到全肠道喂养时间、有创机械通气时间分别比较,差异亦均无统计学意义(P>0.05)。
综上所述,本研究结果显示,布洛芬治疗hsPDA超早产儿的安全性与对乙酰氨基酚相似,但是其治疗疗效,显著高于对乙酰氨基酚。由于本研究仅为单中心研究,纳入样本量相对较小,因此布洛芬与对乙酰氨基酚治疗hsPDA超早产儿的疗效及安全性比较,尚需大样本、多中心、随机对照试验进一步研究、证实。
参考文献
[1] Ohlsson A,Shah SS.Ibuprofen for the prevention of patent ductus arteriosus in preterm and/or low birth weight infants [J].Cochrane Database Syst Rev,2020,1(1):CD004213.DOI:10.1002/14651858.CD004213.pub5.
[2] El-Mashad AE,El-Mahdy H,El Amrousy,et al.Comparative study of the efficacy and safety of paracetamol,ibuprofen,and indomethacin in closure of patent ductus arteriosus in preterm neonates [J].Eur J Pediatr,2017,176(2):233-240.DOI:10.1007/s00431-016-2830-7.
[3] Tofe I,Ruiz-González MD,Caňete MD,et al.Efficacy of paracetamol in closure of ductus arteriosus in infants under 32 weeks of gestation [J].Front Pediatr,2018,6:25-30.DOI:10.3389/fped.2018.00025.
[4] Lu J,Li Q,Zhu L,et al.Oral ibuprofen is superior to oral paracetamol for patent ductus arteriosus in very low and extremely low birth weight infants [J].Medicine (Baltimore),2019,98(31):e16689.DOI:10.1097/MD.0000000000016689.
[5] 陈俊,田鸾英,吴本清,等.对乙酰氨基酚治疗早产儿症状性动脉导管未闭的多中心随机对照研究[J].广东医学,2019,40(4):535-538.DOI:10.13820/j.cnki.gdyx.20184187.Chen J,Tian LY,Wu BQ,et al.A multicenter randomized controlled study on the efficacy and safety of paracetamol on symptomatic patent ductus arteriosus in premature infants [J].Guangdong Med J,2019,40(4):535-538.DOI:10.13820/j.cnki.gdyx.20184187.
[6] 田方,石文静.胎龄<28 周早产儿动脉导管未闭的治疗进展[J].中国当代儿科杂志,2015,17(10):1142-1147.DOI:10.7499/j.issn.1008-8830.2015.10.025.Tian F,Shi WJ.Progress in management of patent ductus arterious in preterm infants with gestational age of <28 weeks [J].Chin J Contemp Pediatr,2015,17(10):1142-1147.DOI:10.7499/j.issn.1008-8830.2015.10.025.
[7] Susheel Kumar TK.Surgical management of patent ductus arteriosus [J].Congenit Heart Dis,2019,14(1):57-59.DOI:10.1111/chd.12699.
[8] Conrad C,Newberry D.Understanding the pathophysiology,implications,and treatment options of patent ductus arteriosus in the neonatal population [J].Adv Neonatal Care,2019,19(3):179-187.DOI:10.1097/ANC.0000000000000590.
[9] Ohlsson A,Shah SS.Ibuprofen for the prevention of patent ductus arteriosus in preterm and/or low birth weight infants [J].Cochrane Database Syst Rev,2019,6(6):CD004213.DOI:10.1002/14651858.CD004213.pub4.
[10] Poon WB,Tagamolila V.Cerebral perfusion and assessing hemodynamic significance for patent ductus arteriosus using near infrared red spectroscopy in very low birth weight infants [J].J Matern Fetal Neonatal Med,2019:1-6.DOI:10.1080/14767058.2019.1644313.
[11] Arman D,Sancak S,Gürsoy T,et al.The association between NIRS and Doppler ultrasonography in preterm infants with patent ductus arteriosus [J].J Matern Fetal Neonatal Med,2020,33(7):1245-1252.DOI:10.1080/14767058.2019.1639661.
[12] Martini S,Aceti A,Galletti S,et al.To feed or not to feed:a critical overview of enteral feeding management and gastrointestinal complications in preterm neonates with a patent ductus arteriosus [J].Nutrients,2019,12(1):83.DOI:10.3390/nu12010083.
[13] Vettukattil JJ.Pathophysiology of patent ductus arteriosus in the preterm infant [J].Curr Pediatr Rev,2016,12(2):120-122.DOI:10.2174/157339631202160506002215.
[14] Su BH,Lin HY,Chiu HY,et al.Therapeutic strategy of patent ductus arteriosus in extremely preterm infants [J].Pediatr Neonatol,2020,61(2):133-141.DOI:10.1016/j.pedneo.2019.10.002.
[15] Malviya MN,Ohlsson A,Shah SS.Surgical versus medical treatment with cyclooxygenase inhibitors for symptomatic patent ductus arteriosus in preterm infants [J].Cochrane Syst Rev,2013,2013(3):CD003951.DOI:10.1002/14651858.CD003951.pub3.
[16] Lucas R,Warner TD,Vojnovic I,et al.Cellular mechanisms of acetaminophen:role of cyclo-oxygenase [J].FASEB J,2005,19(6):635-637.DOI:10.1096/fj.04-2437fje.
[17] Chen W,Pawelek TR,Kulmacz RJ.Hydroperoxide dependence and cooperative cyclooxygenase kinetics in prostaglandin H synthase-1 and -2 [J].J Biol Chem,1999,274(29):20301-20306.DOI:10.1074/jbc.274.29.20301.
[18] Dani C,Poggi C,Mosca F,et al.Efficacy and safety of intravenous paracetamol in comparison to ibuprofen for the treatment of patent ductus arteriosus in preterm infants:study protocol for a randomized control trial [J].Trials,2016,17:182.DOI:10.1186/s13063-016-1294-4.
