SCN1A、SCN2A基因多态性对癫痫儿童丙戊酸钠治疗效果的影响
摘 要:目的:分析SCN1A、SCN2A基因多态性对丙戊酸钠治疗癫痫患儿的疗效影响。方法:采用PCR和Sanger测序法检测128例丙戊酸钠规范治疗的癫痫患儿(有效组76例、无效组52例)外周血SCN1A(rs10188577、rs2298771、rs3812718、rs1813502)、SCN2A(rs2304016、rs17183814)多态性。采用非条件Logistic回归分析基因型、等位基因频率与丙戊酸钠疗效的关系,分析不同基因型患者丙戊酸钠血药浓度的差异。结果:SCN1A基因rs3812718位点多态性与丙戊酸钠治疗效果有关。携带GA和AA基因型的患者采用丙戊酸钠治疗有效(GG vs GA:OR=1. 186,95%CI 0. 965~2. 304,P=0. 015; GG vs AA:OR=1. 252,95%CI 1. 007~3. 254,P=0. 002)。有效组SCN1A基因rs3812718位点A等位基因频率明显高于无效组(OR=1. 452,95%CI 1. 052~2. 695,P=0. 010)。其余基因位点组间比较差异均无统计学意义(P> 0. 05)。结论:SCN1A基因rs3812718位点多态性可能与丙戊酸钠抗癫痫效应有关。
关键词:SCN1A SCN2A 基因多态 癫痫 儿童 丙戊酸钠 血药浓度
癫痫是小儿神经系统常见疾病,发病率为41/1 000 000~187/1 000 000[1]。抗癫痫药物(antiepileptic drugs,AEDs)是治疗癫痫的常用药物,但是临床上仍有30%的患者在足量、足疗程治疗后会复发[2]。丙戊酸钠是一种非选择性钠离子通道阻滞剂,可以通过表观遗传通路下调钠通道Scn3a基因表达[3]。丙戊酸钠是治疗癫痫的一线药物,对控制癫痫全身发作和局部发作具有较好的效果,但是这种效果受基因变异的影响较大。Feng W等[4]发现,UGT2B7、SCN1A和CYP3A4基因多态性会影响丙戊酸钠治疗癫痫全身性发作的效果。
电压门控钠离子通道是AEDs常见的作用靶点,编码离子通道α亚基的SCN1A、SCN2A基因突变与丙戊酸钠和卡马西平治疗应答率和耐药密切相关[5-6]。黄建敏等[7]发现,SCN1A基因rs3812718多态性与卡马西平治疗效果有关。在丙戊酸钠治疗成人癫痫的研究中,Shi L等[6]发现SCN1A rs3812718和SCN2A rs2304016多态性与疗效有关。但是既往也有结论相反的研究,例如Haerian B S等[8]发现,SCN1A、SCN2A基因多态性均与AEDs(卡马西平、苯妥英钠、拉莫三嗪、丙戊酸钠)治疗应答率无关。研究结果的差异可能与样本量、患儿年龄、种族、AEDs类型等有关,因此需要进一步分析。
SCN1A、SCN2A基因多态性与丙戊酸钠疗效关系的研究既往多为成年人,对儿童少有报道。本研究旨在探讨SCN1A、SCN2A基因多态性对丙戊酸钠治疗儿童癫痫疗效的影响。
1 资料和方法
1.1 研究对象
选取2017年6月至2018年8月我院收治的128例癫痫患儿为研究对象。纳入标准:(1)结合临床表现、脑电图及影像学检查等确诊为癫痫;(2)年龄<18岁;(3)三代均为汉族;(4)服用丙戊酸钠治疗1年以上,剂量为10~30 mg/(kg·d)。排除标准:(1)同时服用其他抗癫痫药物;(2)脑器质性疾病或其他中枢系统疾病;(3)代谢性疾病。根据抗癫痫治疗效果,将128例患儿分为有效组(n=76)和无效组(n=52)。疗效评价标准[7]:有效———固定剂量丙戊酸钠治疗后,1年内未出现任何类型的癫痫发作,或发作频率减少50%~99%;无效———1年内,应用最大剂量丙戊酸钠治疗后,仍无法控制症状,发作频率减少<50%,需要换用其他AEDs。本研究已经过我院伦理委员会批准,所有患儿家属均签署知情同意书。
1.2 方法
1.2.1 基因多态性检测
采集外周静脉血3 m L于EDTA管,用1.5 m L EP管分装,置于-70℃冰箱中保存。用全血基因组DNA提取试剂盒(赛默飞世尔科技有限公司)提取DNA。用Primer 5.0设计引物,由广州沛瑜生物制品有限公司进行合成。所选SNP位点包括:SCN1A (rs10188577、rs2298771、rs3812718、rs1813502)和SCN2A(rs2304016、rs17183814)。PCR步骤:在95℃下初步变性3 min;在94℃下变性30 s,35个循环;退火30 s;72℃下延伸30 s;72℃下最后延伸10 min。PCR产物用1.5%琼脂糖凝胶电泳鉴定。鉴定后的产物用3730XL全自动DNA测序仪(美国ABI公司)进行测序(Sanger测序法)[9]。
1.2.2 丙戊酸钠血药浓度检测
用气相色谱法检测丙戊酸钠血药浓度。GC-14C气相色谱分析仪由日本岛津公司生产,色谱柱为HP-5毛细管柱(杭州库仑科技有限公司)[10]。
1.3 统计学方法
应用SPSS 20.0进行统计学分析,计量资料比较采用独立样本t检验;计数资料采用χ2检验。非条件Logistic回归分析基因型、等位基因频率与丙戊酸钠疗效的关系,计算OR和95%CI。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
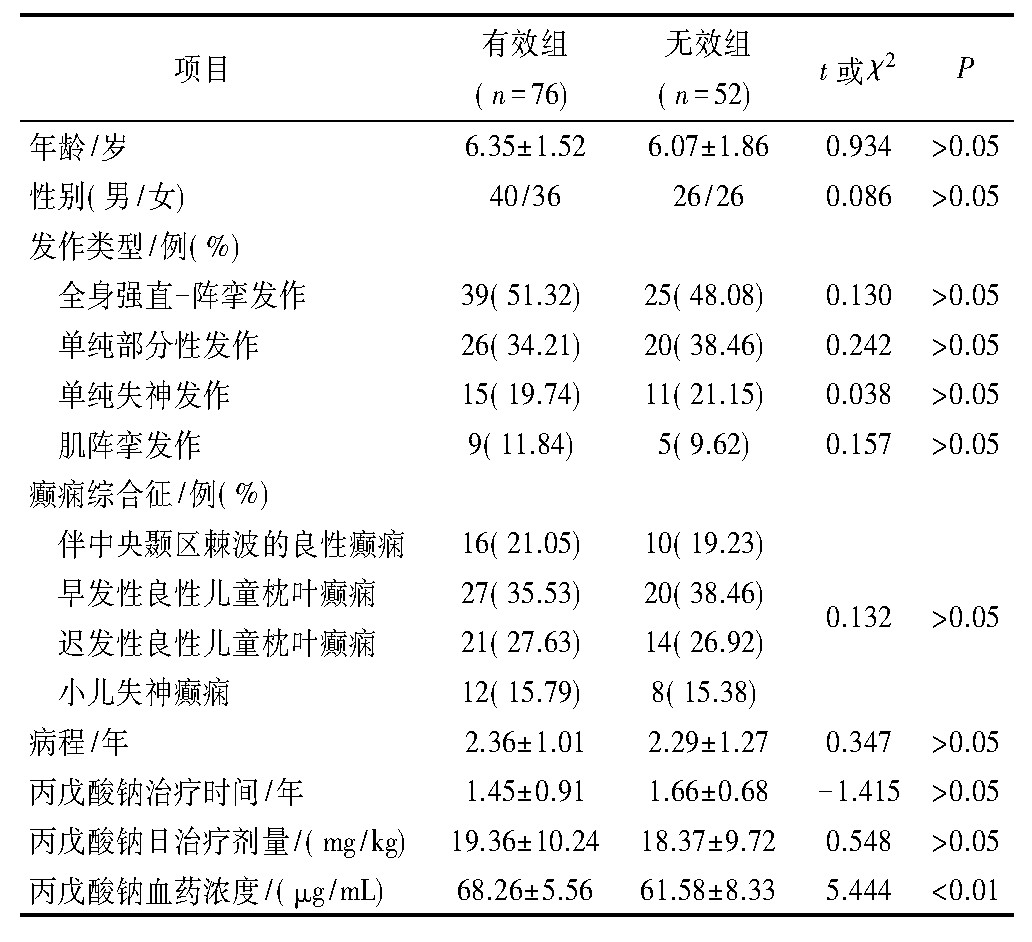
除丙戊酸钠血药浓度外,两组患儿一般资料比较差异无统计学意义(P>0.05),见表1。
表1 两组患儿一般资料比较
2.2 Hardy-Weinberg遗传平衡分析
128例患儿SCN1A(rs10188577、rs2298771、rs3812718、rs1813502)和SCN2A (rs2304016、rs17183814)位点均符合Hardy-Weinberg遗传平衡(P>0.05),说明样本具有代表性。
2.3 SCN1A和SCN2A基因多态性与丙戊酸钠疗效的关系
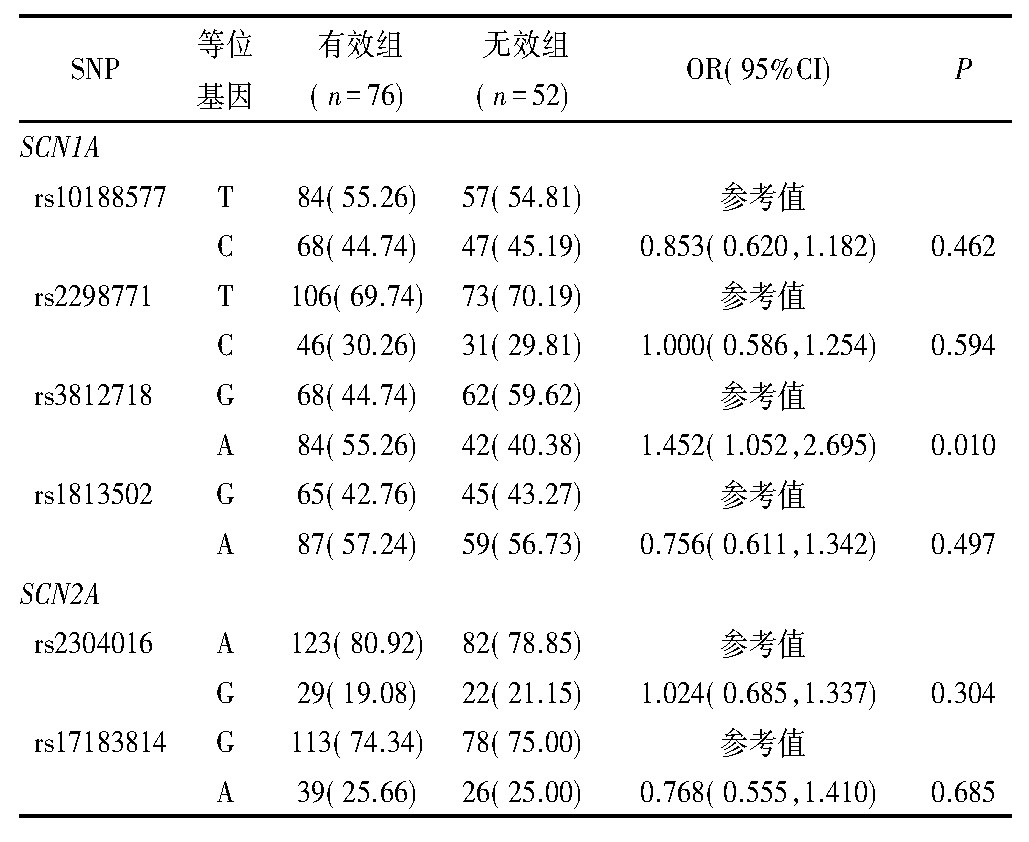
非条件Logistic回归分析结果显示,SCN1A基因rs3812718位点多态性与丙戊酸钠治疗效果有关。携带GA和AA基因型的患者用丙戊酸钠治疗有效(GG vs GA:OR=1.186,95%CI 0.965~2.304,P=0.015;GG vs AA:OR=1.252,95%CI 1.007~3.254,P=0.002)。有效组SCN1A基因rs3812718位点A等位基因频率明显高于无效组(OR=1.452,95%CI 1.052~2.695,P=0.010)。见表2、表3。
表2 两组患儿基因型分布频率比较
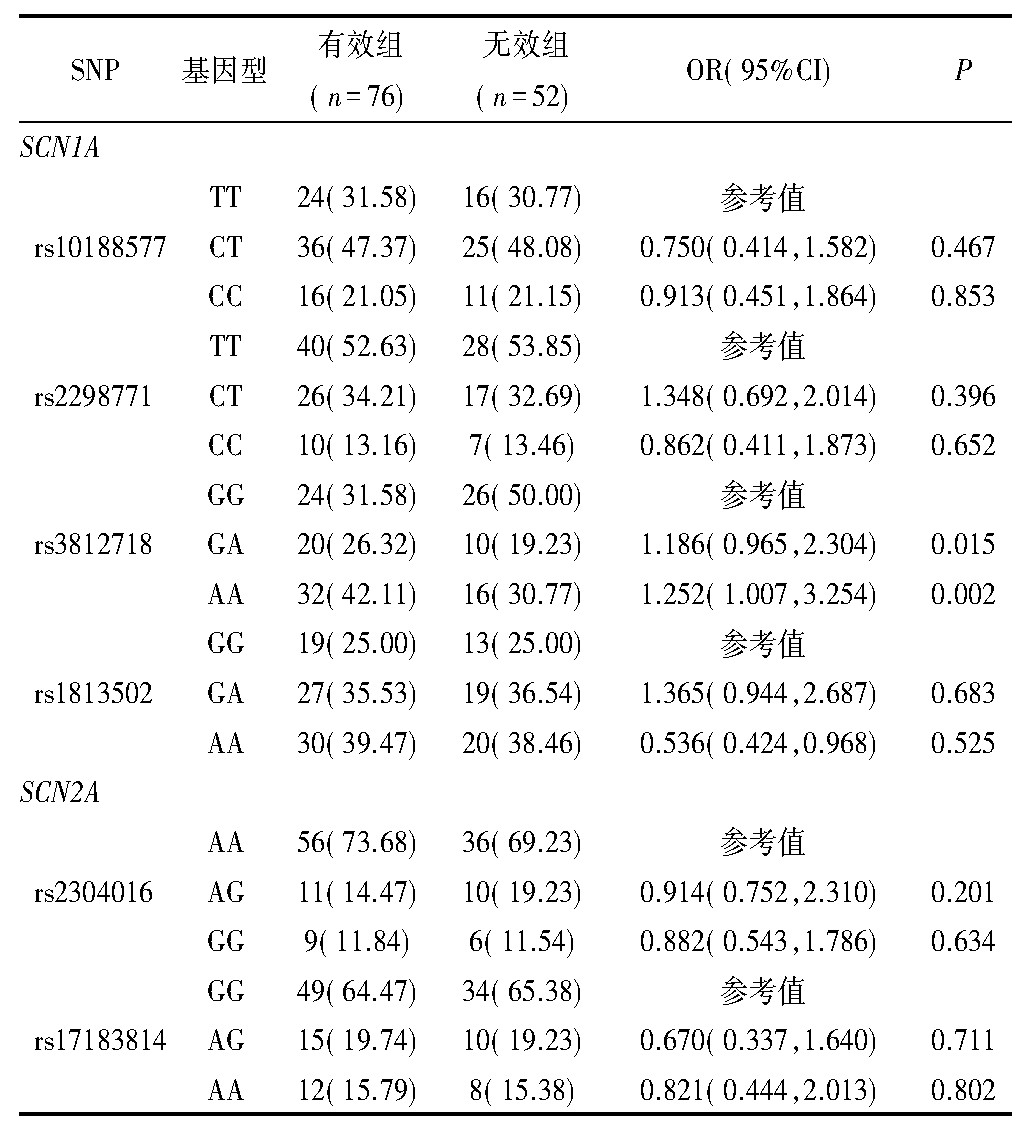 表3 两组患儿等位基因型分布频率比较
表3 两组患儿等位基因型分布频率比较
3 讨论
电压门控钠离子通道基因突变可参与癫痫的发生,并影响个体对AEDs的反应性[11]。电压门控钠离子通道由一个α亚基和多个β亚单位组成,其中α亚基是主要结构和功能单位。既往研究显示,α亚基的基因SCN1A和SCN2A突变与儿童癫痫的发生有关[12-13]。丙戊酸钠可能通过阻滞钠离子通道发挥抗癫痫作用,因此钠离子通道基因突变可导致药物作用靶点发生结构和功能的变化,使药物无法与靶点结合,从而抑制神经元放电,出现药物抵抗。
既往SCN1A和SCN2A基因突变与AEDs疗效关系的报道,结论不一致。如黄建敏等[7]发现,SCN1A基因rs3812718多态性与卡马西平治疗效果有关,AA基因型患者的抗癫痫治疗效果较差。而Haerian B S等[8]发现,SCN1A、SCN2A基因多态性均与AEDs (卡马西平、拉莫三嗪、丙戊酸钠)治疗应答率无关。研究结果的差异可能与样本量、患者年龄、种族、AEDs类型等有关。为了排除以上干扰因素,本研究以汉族儿童癫痫患者为研究对象,单独采用丙戊酸钠治疗。丙戊酸钠是治疗儿童癫痫的常用药物,可通过促进钠离子通道Na_V1.1膜蛋白表达,参与抗癫痫治疗过程[14]。
本研究结果显示,在SCN1A四个基因位点和SCN2A两个基因位点中,仅SCN1A基因rs3812718位点多态性与丙戊酸钠疗效有关。GA和AA基因型的患者用丙戊酸钠治疗有效,携带A等位基因的患者治疗有效。既往也有研究发现,rs3812718位点多态性与难治性癫痫有关[15]。但是来自印度的一项研究却发现,rs3812718位点多态性仅与癫痫易感性有关,而与药物应答率和耐药性无关[16]。说明基因变异在抗癫痫效果中的作用受种族和环境的影响。国内Bao Y等[17]开展了一项meta分析,结果显示SCN1A基因rs3812718位点多态性与AEDs抵抗无关,而rs2298771多态性与之有关。但本研究发现,丙戊酸钠治疗有效组和无效组rs2298771基因型和等位基因分布频率的比较差异无统计学意义,可能与样本量和患者年龄有关。SCN2A基因突变与癫痫发生和癫痫表型有关[13]。Nazish H R等[18]发现,SCN2A(56G>A)多态性与卡马西平治疗巴基斯坦癫痫患者的应答率有关。而本研究并未发现SCN2A基因多态性与丙戊酸钠疗效有关,与Li X等[19]报道一致。
综上所述,本研究发现SCN1A基因rs3812718位点多态性与丙戊酸钠抗癫痫效应有关,携带GA和AA基因型的患者用丙戊酸钠治疗的效果较好,SCN2A基因多态性与丙戊酸钠治疗效果无关。SCN1A基因变异只会影响丙戊酸钠抗癫痫效应,不会影响血药浓度。然而本研究也存在一些局限性,如样本量较小,因此未对性别、癫痫类型进行分层分析。
参考文献
[1]CAMFIELD P,CAMFIELD C.Incidence,prevalence and aetiology of seizures and epilepsy in children[J].Epileptic Disord,2015,17(2):117-123.
[2]CROSS J H,COCK H.A perspective on cannabinoids for treating epilepsy:do they really change the landscape?[J].Neuropharmacology,2019(23):107861.
[3]TAN N N,TANG H L,LIN G W,et al.Epigenetic down regulation of SCN3A expression by valproate:a possible role in its anticonvulsant activity[J].Mol Neurobiol,2017,54(4):2831-2842.
[4]FENG W,MEI S,ZHU L,et al.Effects of UGT2B7,SCN1A and CYP3A4 on the therapeutic response of sodium valproate treatment in children with generalized seizures[J].Seizure,2018,58:96-100.doi:10.1016/j.seizure.2018.04.006.
[5]HUNG C C,CHANG W L,HO J L,et al.Association of polymorphisms in EPHX1,UGT2B7,ABCB1,ABCC2,SCN1Aand SCN2A genes with carbamazepine therapy optimization[J].Pharmacogenomics,2011,13(2):159-169.
[6]SHI L,ZHU M,LI H,et al.SCN1A and SCN2A polymorphisms are associated with response to valproic acid in Chinese epilepsy patients[J].Eur J Clin Pharmacol,2019,75(5):655-663.
[7]黄建敏,钱哲,陈海燕,等.SCN1A基因单核苷酸多态性与广西壮族癫痫卡马西平疗效的相关性[J].中华医学遗传学杂志,2019,36(3):271-274.
[8]HAERIAN B S,BAUM L,KWAN P,et al.SCN1A,SCN2A and SCN3A gene polymorphisms and responsiveness to antiepileptic drugs:a multicenter cohort study and meta-analysis[J].Pharmacogenomics,2013,14(10):1153-1166.
[9]LUO Y,LUO J,PENG H.Associations between genetic polymorphisms in the VEGFA,ACE,and SOD2 genes and susceptibility to diabetic nephropathy in the Han Chinese[J].Genet Test Mol Biomarkers,2019,23(9):644-651.
[10]赵树跃,杜丽新,李书清,等.气相色谱法测定丙戊酸血药浓度[J].标记免疫分析与临床,2014,21(4):484-486.
[11]BOUZA A A,ISOM L L.Voltage-gated sodium channel beta subunits and their related diseases[J].Handb Exp Pharmacol,2018,246:423-450.doi:10.1007/164_2017_48.
[12]FANG Z X,HONG S Q,LI T S,et al.Genetic and phenotypic characteristics of SCN1A-related epilepsy in Chinese children[J].Neuroreport,2019,30(9):671-680.
[13]曾琦,张月华,杨小玲,等.SCN2A基因突变导致的癫痫表型特点[J].中华儿科杂志,24(7):518-523.
[14]金超,郝立成,陈娜,等.丙戊酸钠单药治疗学龄期癫痫患儿的疗效及对认知功能的影响[J].儿科药学杂志,2019,25(7):23-27.
[15]WANG Z J,CHEN J,CHEN H L,et al.Association between SCN1A polymorphism rs3812718 and valproic acid resistance in epilepsy children:a case-control study and meta-analysis[J].Biosci Rep,2018,38(6):1-8.
[16]KUMARI R,LAKHAN R,KUMAR S,et al.SCN1A IVS5-91 G>Apolymorphism is associated with susceptibility to epilepsy but not with drug responsiveness[J].Biochimie,2013,95(6):1350-1353.
[17]BAO Y,LIU X,XIAO Z.Association between two SCN1Apolymorphisms and resistance to sodium channel blocking AEDs:a meta-analysis[J].Neurol Sci,2018,39(6):1065-1072.
[18]NAZISH H R,ALI N,ULLAH S.The possible effect of SCN1Aand SCN2A genetic variants on carbamazepine response among Khyber Pakhtunkhwa epileptic patients,Pakistan[J].Ther Clin Risk Manag,2018(14):2305-2313.
[19]LI X,ZHANG J,WU X,et al.Polymorphisms of ABAT,SCN2Aand ALDH5A1 may affect valproic acid responses in the treatment of epilepsy in Chinese[J].Pharmacogenomics,2016,17(18):2007-2014.


