经支气管冷冻肺活检在尘肺病诊断中的应用
摘要:目的 探讨经支气管冷冻肺活检(TBCB)在尘肺病诊断中的有效性和安全性。方法 收集2016年5月至2018年11月重庆医科大学附属第一医院收治的接尘且诊断不明患者14例。将肺活检组织的病理结果,结合粉尘接触史、临床及影像学特征等进行综合分析,明确TBCB对尘肺病诊断的有效性。观察并记录术中、术后并发症的发生率及严重程度,明确TBCB对尘肺病诊断的安全性。结果 14例接受TBCB的患者中有13例在硬质支气管镜联合软性支气管镜下完成,1例在气管插管联合软性支气管镜下完成,操作时间(50.71±21.86)min。每例获得组织标本数量为(6.71±1.27)块,标本大小为8(1,25)mm2。病理诊断提示:11例职业相关的间质性肺病;1例普通型间质性肺炎;1例提示肉芽肿,考虑增殖性结核或结节病可能;1例过敏性肺泡炎可能。经多学科会诊,最终确诊尘肺病7例,普通间质性肺炎1例,结节病1例,过敏性肺泡炎1例,4例诊断不明,明确诊断率71.43%(10/14)。根据2013英国胸科协会制定的成人支气管镜检查指南行术中出血分级,术中严重出血2例,中度出血3例,经止血处理后出血均停止;气胸1例,肺压缩约30%,行胸腔穿刺抽气后吸收。结论 TBCB是一种安全有效的肺活检技术,可获得尘肺病病理学证据,对尘肺病的诊断及鉴别诊断具有较高的应用价值。
关键词:尘肺病; 经支气管冷冻肺活检; 病理; 诊断;
在职业活动中长期吸入生产性矿物性粉尘并在肺内潴留而引起的以肺组织弥漫性纤维化为主的疾病称为尘肺病[1]。目前国内对尘肺病的诊断主要依据可靠的职业性粉尘接触史结合高千伏胸片或数字化摄影(DR)后前位胸片[1]。由于工人流动性强、工作环境复杂、工人自身缺乏卫生健康监测意识等诸多问题,导致患者有时难以提供确切的粉尘接触史和质量合格的影像学资料。另外以间质性肺病(interstitial lung disease,ILD)为主的肺部弥漫性病变病因较多,而不典型尘肺病的临床症状及影像学表现缺乏特异性,因此尘肺病漏诊、误诊的情况非常普遍。临床上急需一种安全、有效的肺组织活检技术以提高尘肺病的诊断效率。外科肺活检(surgical lung biopsy,SLB)获取组织样本大,但创伤大、费用高,对心肺功能要求高,临床应用率很低。国内外多项研究表明,经支气管冷冻肺活检术(transbronchial cryobiopsy,TBCB)能获取较大且质量高的组织标本,对肺部弥漫性病变的诊断效能较高[2-7],有望替代80%以上的SLB,但目前尚未见其在尘肺病诊断中应用的报道。本研究通过对诊断不明的14例接尘患者进行TBCB获取肺活检组织标本,研究其在尘肺病诊断中的应用价值。
1 资料与方法
1.1 对象
2016年5月至2018年11月期间在重庆医科大学附属第一医院收治的接尘患者中诊断不明且符合下述纳入标准者14例,均同意行TBCB取肺组织送检病理检查。
纳入标准:(1)有职业粉尘暴露史,时间≥6个月。(2)胸部影像学可见肺部结节或小片状影、磨玻璃影、蜂窝肺、网格状影、纵隔淋巴结钙化等表现。(3)经实验室、影像学、常规支气管镜检查等仍不能确诊。
排除标准:(1)存在心肺功能不全、凝血障碍等支气管镜检查禁忌证。(2)具有两张以上间隔时间超过半年的动态胸片,有可靠的粉尘接触史和职业卫生学调查资料支持,有典型的尘肺病X射线胸片表现,根据临床及影像学资料即可确诊尘肺病,并有明确的临床资料可排除其他疾病。
本研究经重庆医科大学附属第一医院伦理委员会批准(20160302)。
1.2 方法
1.2.1 TBCB
13例由硬质支气管镜联合软性支气管镜完成活检,具体方法参考文献[8],1例在气管插管联合软性支气管镜下完成,具体方法参考文献[9]。术前完善血常规、凝血象、心电图、心脏彩超等,经多学科讨论评估出血风险、心肺功能,通过胸部HRCT确定远离叶间裂、肺大泡、蜂窝肺、空洞的地方选取2~3个胸膜下1~2 cm活动性病灶最集中的部位作为活检靶部位,麻醉后静脉推注凝血酶2U预防出血,将软镜置于活检靶部位所在叶段支气管开口,将冷冻探头(德国ERBE,型号:20416-032,20416-037)置入相应段支气管内直到不能再伸入时(抵近胸膜)将探头后退2 cm,冷冻3~7 s后立即将冷冻探头与软镜一起退出气道后取下组织并测量,然后立即再次进入气道内了解出血等并发症情况,必要时通过抽吸、局部喷注冷生理盐水、1∶10000肾上腺素、球囊封堵等止血,同时听诊活检侧肺呼吸音等了解气胸发生情况,若无严重并发症发生则重复上述步骤,多部位多次取材,同部位活检次数不超过4次。硬镜下操作时术中备用止血球囊(德国ENDO-FLEX公司N135030PRO取石球囊导管),发生严重出血时用于局部封堵止血,气管插管联合软镜下TBCB常规预置止血球囊[7]。
1.2.2 标本保存及处理
TBCB标本,具体操作参考文献[4]。取下标本后立即测量大小(长径×短径=面积mm2),然后将标本放入10%中性甲醛液中送至病理科进行石蜡包埋、切片,常规进行抗酸染色及PAS染色,在光学显微镜及偏光显微镜下观察,由病理学专家决定是否进行免疫组化。
1.2.3 病理检查
由重庆医科大学病理科及上海同济医院病理科中至少2位病理科医生完成TBCB活检组织的病理检查,病理诊断依据主要参考GBZ25-2014《职业尘肺病的病理诊断》[10],明确有无粉尘沉积、弥漫性纤维化及粉尘性反应,包括巨噬细胞反应、轻微纤维组织增生等尘肺病理性改变或其他疾病病理改变。
1.2.4 并发症观察
TBCB最常见的并发症是出血和气胸。术中出血分级根据2013英国胸科协会制定的成人支气管镜检查指南分为无出血(仅有血迹,无需吸引,出血能自行停止)、轻度出血(需持续负压吸引,出血可自行停止)、中度出血(需用支气管镜于叶段支气管喷洒冰盐水、肾上腺素止血)、严重出血(需行气道内球囊封堵或外科手术,或死亡)[11]。气胸根据肺压缩程度分为轻度(肺压缩<30%)、中度(肺压缩30%~50%)及重度(肺压缩≥50%)。术后密切观察患者是否出现发热、呼吸困难、咳嗽咳痰加重、咯血或痰中带血等情况。
1.2.5 多学科会诊
综合合格的X射线胸片、明确的粉尘接触史、尘肺流行病学调查资料和健康监护资料,以及临床表现和实验室检查(包括病理检查),根据GBZ70-2015《职业性尘肺病的诊断》、GBZ 25-2014《职业尘肺病的病理诊断》,经呼吸科、放射影像科、病理科及2名具有职业病鉴定资格的专家共同讨论后得出最后诊断。
1.2.6 统计学方法
采用SPSS 22.0版进行数据分析,符合正态分布的计量资料结果以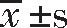 表示,非正态分布的计量资料以M(Q1,Q3)表示。
表示,非正态分布的计量资料以M(Q1,Q3)表示。
2 结果
2.1 临床资料
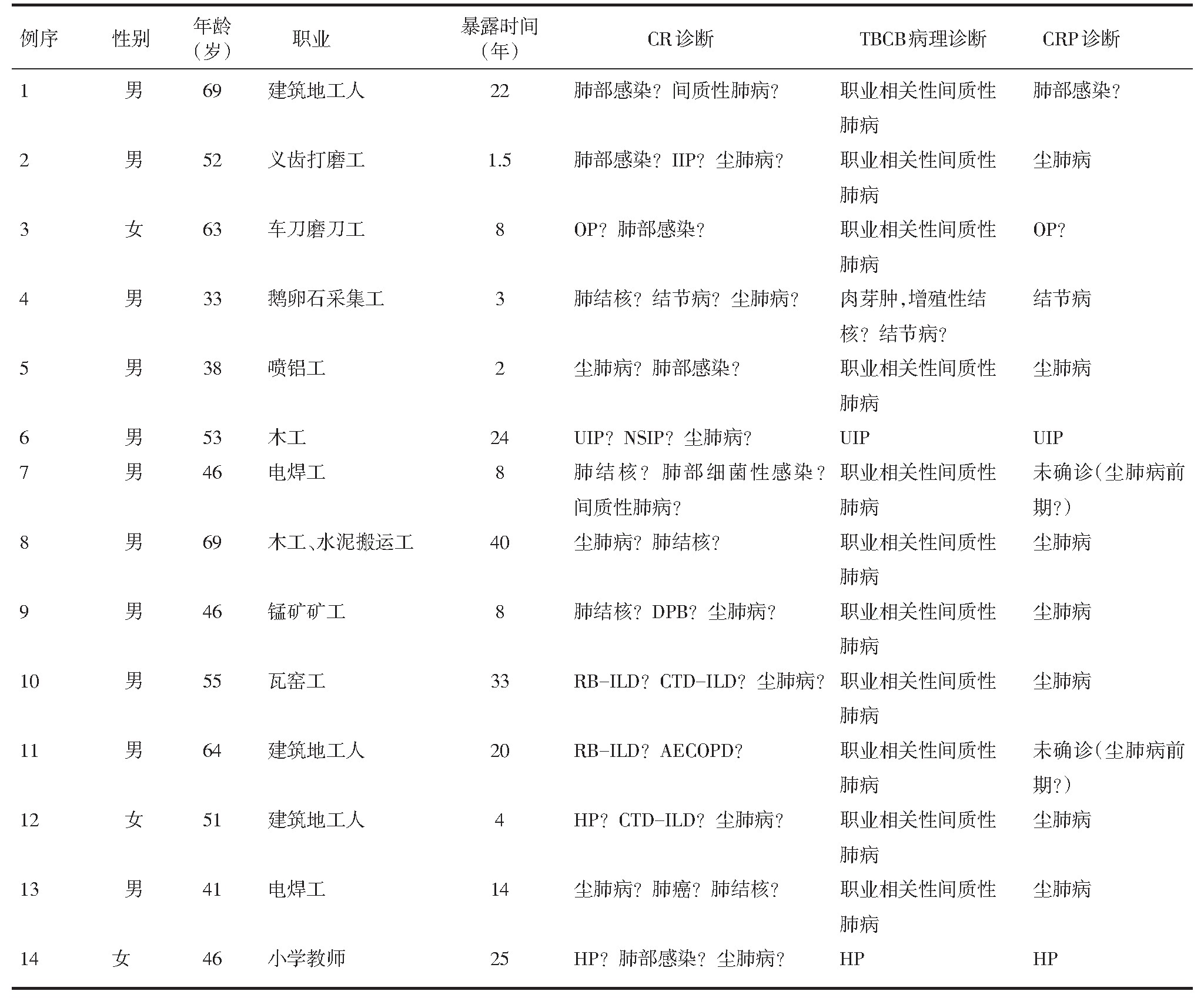
14例接尘患者接受TBCB,其中男11例,女3例;年龄(51.85±11.23)岁;粉尘暴露时间(15.18±12.30)年;包括建筑地工人3例,义齿打磨工1例,机械磨刀工1例,喷铝工1例,木工1例,电焊工2例,锰矿矿工1例,鹅卵石采集工1例,木工转行水泥搬运工1例,接触粉笔灰的教师1例,瓦窑工1例。主要有咳嗽、咳痰、喘累等非特异症状。患者胸部CT表现为磨玻璃影8例(57.14%),小结节5例(35.71%),条片状高密度影1例(7.14%)。见表1。
表1 14例患者的粉尘接触史及CR、病理、CRP诊断结果
 2.2活检情况
2.2活检情况
14例接尘患者的TBCB中有13例在硬质支气管镜联合软性支气管镜下完成,1例在软性支气管镜下完成,总活检次数94次(右下叶54次,右上叶24次,右中叶12次,左下叶4次),共获得标本94块,每例获得组织标本数量为(6.71±1.27)块,标本大小为8(1,25)mm2,手术操作时间(50.71±21.86)min。见表2。
表2 14例患者活检及并发症情况
 2.3 诊断结果
2.3 诊断结果
14例患者病理检查中11例提示职业相关性间质性肺病(肺间质纤维化4例,尘性结节2例,尘性结节伴肺间质纤维化2例,粉末沉积伴肺间质纤维化2例,尘性结节、粉末沉积伴肺间质纤维化1例),1例提示UIP样改变,1例可见肉芽肿,未见干酪样坏死,考虑增殖性结核或结节病可能,1例考虑过敏性肺泡炎可能。该14例术前通过临床表现、影像学检查、实验室检查、常规支气管镜检查均诊断不明,术后结合病理检查结果,经多学科讨论后确诊尘肺病7例,普通间质性肺炎1例,结节病1例,过敏性肺泡炎1例,1号、3号、7号、11号病例诊断不明,明确诊断率71.43%(10/14)。见表1。
1号患者有22年建筑工地搬运工职业史,术前胸部HRCT提示双肺炎症性改变,无尘肺影像学表现,结合实验室检查提示白细胞、中性粒细胞比升高,考虑肺炎可能性大,但术后病理诊断提示职业相关性间质性肺病。3号患者有8年车刀磨工职业史,术前胸部HRCT提示双肺条片状高密度影,机化性肺炎可能?无尘肺影像学表现,但术后病理诊断提示职业相关性间质性肺病。经多学科讨论,1号和3号病理诊断结果和影像学表现不一致,结合临床均未能确诊。7号和11号均有明确长期粉尘接触史,术前胸部HRCT提示双肺多发浅淡小结节,符合尘肺早期表现,但尚未达到尘肺病壹期诊断的起点,此2例患者术后组织中均发现尘细胞和(或)尘结节,为进一步明确诊断,我科将此2例患者的肺泡灌洗液送至重庆医科大学法医研究所行电镜能谱分析(荷兰飞纳电镜能谱一体机phenom ProX),同时送检无粉尘接触史的患者的肺泡灌洗液作为对照液,经电镜能谱分析发现与对照液相比7号患者的肺泡灌洗液中有较多不规则金属铁的物质,少许含金属锰、金属镍的物质,11号患者肺泡灌洗液中存在较多含硅、金属铁的物质,经多学科讨论后,结合患者临床、影像学、病理诊断及电镜能谱分析结果,考虑患者有尘肺病前期表现,但尚未达尘肺病1期,建议患者尽快脱离粉尘环境,密切随访。见表1。
2.4 手术并发症观察
13例硬镜结合软镜中有2例出血经常规方法止血无效,予以球囊封堵后有效止血,按2013英国胸科协会制定的成人支气管镜检查指南属于严重出血;有3例予以镜下喷洒冰盐水及1∶10000肾上腺素止血成功,属于中度出血;1例软镜下TBCB常规预置球囊封堵,出血量少;1例发生气胸,肺组织压缩约30%,予以胸腔穿刺抽气后吸收。未出现喉、气管或支气管痉挛、继发性肺部感染、纵隔气肿、恶性心律失常、死亡等并发症。见表2。
2.5 典型病例
(1)病例9:患者男,46岁,既往于锰矿矿场做矿工8年。主要症状为咳嗽、咳痰,完善胸部CT后结合患者职业史、临床资料无法确诊,2018年5月7日于我科行TBCB,病检结果回示后经多学科会诊后诊断尘肺病。图1 :双肺野弥漫粟粒样浅淡密度灶,双肺上叶、右肺中叶多个结节影。图1
:双肺野弥漫粟粒样浅淡密度灶,双肺上叶、右肺中叶多个结节影。图1 :(HE×200)局部肺泡腔扩张融合,部分肺泡腔内见较多尘细胞(箭头指示),符合职业相关间质性肺病。(2)病例11:患者男,64岁,有20年装修工职业史,因长期切割瓷砖而接触大量粉尘。主要症状为咳嗽、咳痰,2018年5月30日于我科行TBCB,肺组织标本镜下见尘结节,但其胸部CT无典型尘肺病改变,为进一步明确病因,将肺泡灌洗液送检电镜能谱分析,发现较多可致肺组织致纤维化的含硅物质,经多学科讨论,考虑尘肺病前期改变,嘱患者尽快脱离粉尘环境,早期行全肺灌洗祛除部分致病颗粒,并加强随访。图1
:(HE×200)局部肺泡腔扩张融合,部分肺泡腔内见较多尘细胞(箭头指示),符合职业相关间质性肺病。(2)病例11:患者男,64岁,有20年装修工职业史,因长期切割瓷砖而接触大量粉尘。主要症状为咳嗽、咳痰,2018年5月30日于我科行TBCB,肺组织标本镜下见尘结节,但其胸部CT无典型尘肺病改变,为进一步明确病因,将肺泡灌洗液送检电镜能谱分析,发现较多可致肺组织致纤维化的含硅物质,经多学科讨论,考虑尘肺病前期改变,嘱患者尽快脱离粉尘环境,早期行全肺灌洗祛除部分致病颗粒,并加强随访。图1 :双肺支气管血管束增多,伴双肺轻度气肿。图1
:双肺支气管血管束增多,伴双肺轻度气肿。图1 :(HE×100)肺组织中均见散在尘肺结节(箭头指示)。
:(HE×100)肺组织中均见散在尘肺结节(箭头指示)。
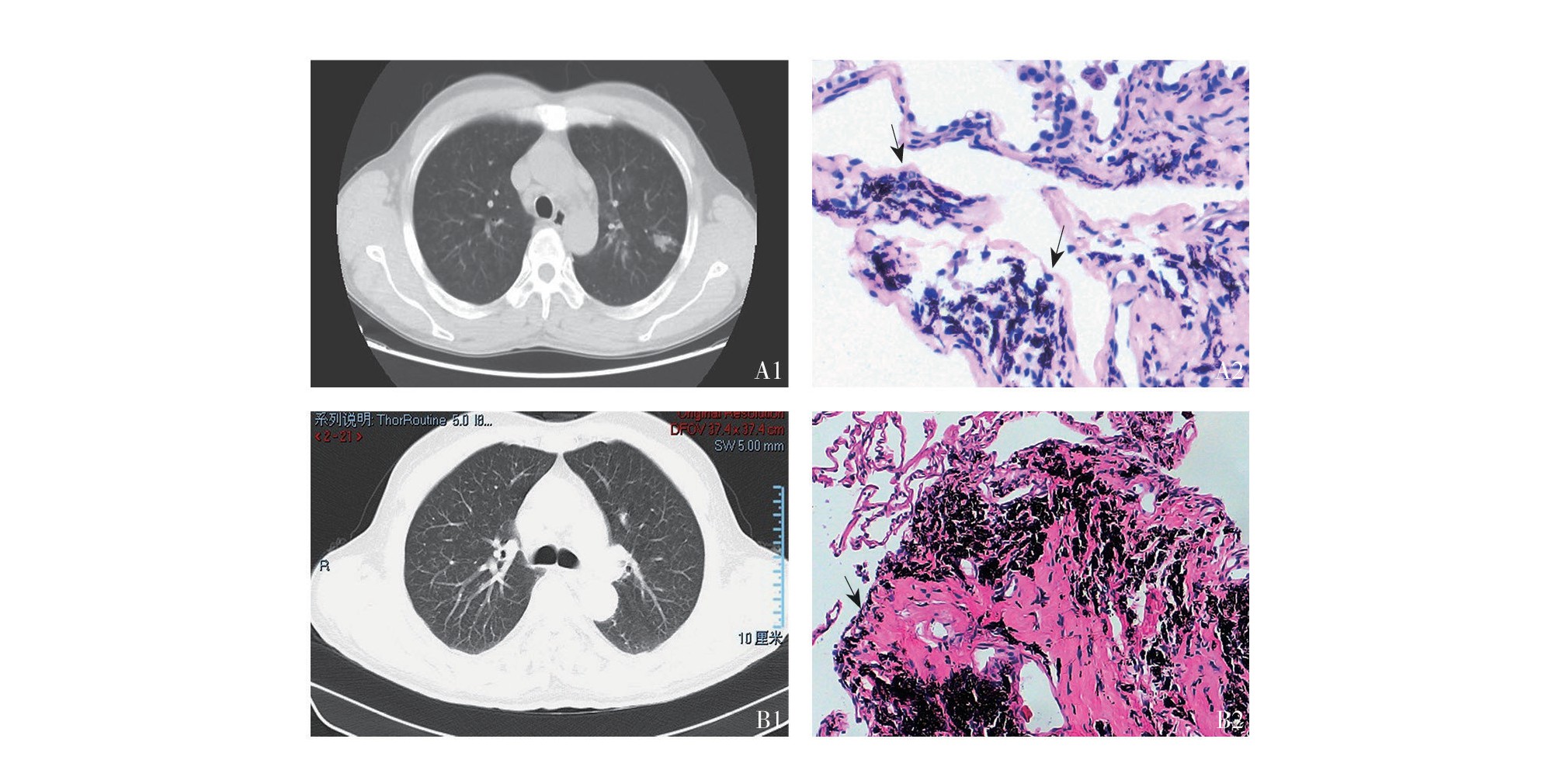 图1 2例典型病例的影像学资料及病理表现
图1 2例典型病例的影像学资料及病理表现
3 讨论
在肺组织活检技术中SLB创伤大、费用高,临床应用少,经支气管镜肺活检术(Transbronchial Lung Biopsy,TBLB)和经皮肺穿刺活检术(Percutaneous Lung Biopsy,PCLB)获取标本量少,组织结构完整性差,难以作为诊断依据,且PCLB取材部位有限,气胸发生率高。由于以上肺组织活检技术的种种限制,尘肺病的诊断轻病理检查、重视影像学及粉尘接触史的现象普遍存在。双肺弥漫性分布的圆形小阴影是尘肺病典型的影像学表现,结合明确的职业性粉尘接触史,容易确立诊断;但当影像学表现不典型或在尘肺病的早期,若没有动态的胸部影像学检查及健康监护资料,则容易漏诊。对于以胸部影像学表现为不规则小阴影或以磨玻璃影为主的尘肺,则非常容易被误诊。早期尘肺病患者如果继续接尘,疾病发展到晚期,预后往往很差,呼吸困难难以改善,生活质量下降,经济支出及心理负担沉重,致残致死率高。因此,早期诊断、早期预防、早期干预意义重大。尘肺病的病理检查能在肺组织标本中发现粉尘所致的早期病理改变,是尘肺病早期诊断的重要手段,因此尘肺病的病理检查应当视为与影像学、粉尘接触史同样重要的诊断方法。这样有望在疾病起跑线上开始干预疾病的发展,改善患者预后,同时推动尘肺病诊断模式由临床-影像经验诊断模式(CR模式)转变为更为严谨、精准的临床-影像-病理诊断模式(CRP模式)。
GBZ 25-2014《职业尘肺病的病理诊断》[10]主要在尸检及外科肺活检时作为诊断尘肺病的依据,但文中也提到小片状肺组织活检可为尘肺病的诊断提供参考依据。尸检对于改善患者预后、生活质量毫无帮助,SLB、TBLB、PCLB在诊断尘肺病方面如前述具有诸多弊端,因此微创有效的肺组织活检技术对尘肺病的早诊断、早治疗、早干预尤为关键。TBCB近年来在国内外得到了广泛的发展应用,它具有创伤小、标本大、安全性高、确诊率高等优势,在ILD的病因诊断方面已经得到专家们的广泛认可,被认为可替代大部分外科肺活检[12],而尘肺病也属于ILD,但目前尚未见TBCB用于尘肺病诊断的报告。为提高尘肺的诊断率,探索TBCB在尘肺病中的诊断效能,我科率先对诊断不明的接尘患者开展了TBCB。所有病例经TBCB均获得质量较好的活检组织。11例患者的组织中可看到肺间质纤维化、尘性结节、粉末沉积、含铁血黄素沉积等病理表现。3例患者分别见到UIP样改变、肉芽肿、过敏性肺泡炎样改变。结合临床及影像学表现,通过多学科讨论,最终7例尘肺病患者得到确诊。TBCB既可以提供尘肺病病理改变的确切证据,且当发现其他疾病病理改变时又可解决鉴别诊断困难的问题。在4例未确诊的病例中,有两例病例存在病理诊断结果与影像学、实验室检查不符,因此最终诊断还需进行多学科讨论,将病理诊断及影像学表现、临床进行综合分析。在另外两例中,患者有明确粉尘接触史,术后病理诊断提示尘细胞/尘结节存在,符合影像学尘肺早期改变。且该两例患者的肺泡灌洗液经电镜能谱分析发现大量的致肺组织纤维化的粉尘颗粒,与各自的粉尘接触史相符。但根据患者DR胸片及胸部HRCT尚不能达尘肺壹期诊断标准,经多学科讨论,考虑为尘肺病前期改变,嘱患者尽早脱离粉尘环境,行全肺灌洗祛除部分致病颗粒,尽量避免尘肺病的发生,加强随访。由此可见TBCB获取组织病理结果结合影像学检查、肺泡灌洗液电镜能谱分析可更早的发现并确认患者的肺部尘肺样改变,对于尘肺的预防及早期干预意义极为重要。
目前临床上常用的肺组织活检方式有TBLB、PCLB和SLB,已有研究表明,TBCB比TBLB获得的活检组织体积更大、组织结构保留更好,对双肺弥漫性病变的诊断率更高[2,5,7,13]。而PCLB不仅获取的组织小、结构易受挤压、病灶位置限于肺外周,而且其气胸发生率可高达61%,平均发生率为20%[14],明显高于TBCB的气胸、血气胸发生率[5-7]。与SLB相比,TBCB具有创伤小、并发症少、经济、条件受限小的优点,在临床上已逐步成为SLB的替代方案,扩大了肺组织活检的适应证[5,7],也可用于肺移植之后的监测[13]。本研究中14例患者总共获取标本94块,每例获得组织标本数量为(6.71±1.27)块,标本大小为8(1,25)mm2,经多位病理学家认为标本质量可为临床提供可靠有效的信息。我科TBCB的标本大小小于文献中提到TBCB获取的平均标本大小23.4 mm2(9.6~37.3 mm2)[6],考虑与冷冻时间(3~7 s)、冷冻探头大小(直径2.4 mm、1.9mm)以及纳入研究的病例数量较少有关。随着手术经验的积累,通过进一步调整冷冻时间,必要时在CT透视、径向超声引导下进行操作可能会更安全地获得更大更优质的组织[7,15-17]。
TBCB最常见的并发症是出血和气胸[5-7]。因为TBCB是通过冷冻探头的黏附性将组织暴力撕裂获取标本的一种活检技术,所以出血是其常见的并发症。本研究中2例出现严重出血,发生率为14.29%(2/14),与文献相近[6],经处理均转归良好。为避免出血,术前评估尤为重要,服用抗凝药物、血小板低于50×109/L、肺动脉高压会增加出血风险[7],所以临床上应严格掌握适应证。使用气管插管联合软镜操作时常规预置止血球囊可降低出血风险,而硬镜下操作因对出血控制能力更强所以对预置球囊没有硬性要求[7]。TBCB时常在近胸膜处取组织标本,可能会导致气胸,本研究中有1例发生气胸,发生率7.14%(1/14),与文献报道相似[7],经胸腔穿刺后吸收。为避免气胸发生,术前我们通过胸部HRCT选取活检靶部位时尽量远离肺大泡、叶间裂、蜂窝肺等位置。根据文献报道当活检位置接近胸膜时,气胸更易发生,所以我们术中严格把握冷冻探头离胸膜位置,距离至少1~2 cm。本研究未出现其他严重并发症,但根据文献报道我们还需警惕纵隔气肿、支气管撕裂、术后间质性肺病急性加重等并发症的发生[18-20]。
通过回顾文献资料并结合本次研究,我们认为TBCB是一种安全有效的肺组织活检技术,能够为尘肺病的诊断提供尘肺病病理改变证据,提高尘肺病的诊断率,降低尘肺病的误诊、漏诊率,尤其是有助于早期尘肺的发现及预警,提醒患者尽早脱离粉尘环境及全肺灌洗祛除部分致病颗粒,避免或减缓尘肺的发生发展。为确保诊断更为可靠,术中取标本可行多部位、多点取样,并结合BALF电镜分析及影像学诊断进行综合分析。对于诊断困难无禁忌证的接尘患者,TBCB值得优先考虑。本研究的局限性在于样本量较小且为单中心回顾性探索性研究,还需要设计良好的随机的大样本量前瞻性研究结果进一步明确TBCB对尘肺病的诊断价值和安全性。
参考文献
[1]中华人民共和国国家卫生和计划生育委员会.职业性尘肺病的诊断:GBZ 70-2015[S].北京:中国标准出版社,2015.
[2] Babiak A, Hetzel J, Krishna G, et al. Transbronchial cryobiopsy:a new tool for lung biopsies.[J]. Respiration, 2009, 78(2):203-208.
[3] Bango-álvarez, Antonio Ariza-Prota M, Torres-Rivas H, et al.Transbronchial cryobiopsy in interstitial lung disease:experience in 106 cases-how to do it[J]. ERJ Open Research, 2017, 3(1):00148-2016.
[4]李一诗,郭述良,易祥华,等.经支气管冷冻肺活检对弥漫性肺疾病病因诊断的有效性和安全性[J].中华医学杂志, 2017, 97(46):3617-3623.
[5] Sharp C, Mccabe M, Adamali H, et al. Use of transbronchial cryobiopsy in the diagnosis of interstitial lung disease—a systematic review and cost analysis[J]. QJM, 2017,110(4):207-214.
[6] Sethi J, Ali MS, Mohananey D, et al. Are transbronchial cryobiopsies ready for prime time?:a systematic review and meta-analysis[J]. J Bronchol Interv Pulmonol, 2018, 26(1):22-32.
[7] Hetzel, Maldonado F, Ravaglia C, et al. Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases:expert statement from the Cryobiopsy Working Group on Safety and Utility and a call for standardization of the procedure[J]. Respiration,2018,95(3):188-200.
[8]李一诗,郭述良,曹友德.经支气管冷冻肺活检二例[J].中华结核和呼吸杂志, 2016, 39(11):905-907.
[9]李一诗,郭述良,贾晋伟,等.软性支气管镜下经支气管冷冻肺活检六例[J].中华医学杂志, 2017, 97(10):782-784.
[10]中华人民共和国国家卫生和计划生育委员会.职业性尘肺病的病理诊断:GBZ 25-2014[S].北京:中国标准出版社,2014.
[11] Du Rand IA, Blaikley J, Booton R, et al. Summary of the British Thoracic Society guideline for diagnostic flexible bronchoscopy in adults[J]. Thorax, 2013, 68(8):786-787.
[12] Raghu G, Collard HR, Egan JJ, et al. ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary fibrosis. An official ATS/ERS/JRS/ALAT statement:idiopathic pulmonary fibrosis:evidence-based guidelines for diagnosis and management[J]. Am J Respir Crit Care Med, 2011, 183(6):788-824.
[13] Montero MA, De Gracia J, Culebras M, et al. The role of transbronchial cryobiopsy in lung transplantation[J]. Histopathology,2018,73(4):593-600.
[14] Anzidei M, Porfiri A, Andrani F, et al. Imaging-guided chest biopsies:techniques and clinical results.[J]. Insights Into Imaging,2017, 8(4):419-428.
[15] Steinfort DP,D'Agostino RD,Vrjlic I,et al. CT-fluoroscopic guidance for performance of targeted transbronchial cryobiopsy:a preliminary report[J].Respiration, 2018, 96(5):472-479.
[16] Wijmans L,Bonta PI,Rocha-Pinto R,et al. Confocal laser endomicroscopy as a guidance tool for transbronchial lung cryobiopsies in interstitial lung disorder[J]. Respiration, 2019, 97(3):259-263.
[17] Gnass M, Filarecka A, Pankowski J, et al. Transbronchial lung cryobiopsy guided by endobronchial ultrasound radial miniprobe in interstitial lung diseases:Preliminary results of a prospective study[J]. Pol Arch Intern Med. 2018,128(4):259-262.
[18] Barisione E,Bianchi R,Fiocca R, et al. Pneumomediastinum after transbronchial cryobiopsy[J].Monaldi Arch Chest Dis, 2018, 88(2):909.
[19] Daniela M, Daniel V, Sofia N, et al. Bronchial laceration as a complication of transbronchial lung cryobiopsy[J]. Arch Bronconeumol, 2018, 54(6):348-350.
[20] Tomic R,Cortes-Puentes GA,Murugan P,et al. Acute exacerbation of interstitial lung disease after cryobiopsy[J]. J Bronchology Interv Pulmonol, 2017, 24(4):319-322.
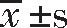 表示,非正态分布的计量资料以M(Q1,Q3)表示。
表示,非正态分布的计量资料以M(Q1,Q3)表示。


 :双肺野弥漫粟粒样浅淡密度灶,双肺上叶、右肺中叶多个结节影。图1
:双肺野弥漫粟粒样浅淡密度灶,双肺上叶、右肺中叶多个结节影。图1 :(HE×200)局部肺泡腔扩张融合,部分肺泡腔内见较多尘细胞(箭头指示),符合职业相关间质性肺病。(2)病例11:患者男,64岁,有20年装修工职业史,因长期切割瓷砖而接触大量粉尘。主要症状为咳嗽、咳痰,2018年5月30日于我科行TBCB,肺组织标本镜下见尘结节,但其胸部CT无典型尘肺病改变,为进一步明确病因,将肺泡灌洗液送检电镜能谱分析,发现较多可致肺组织致纤维化的含硅物质,经多学科讨论,考虑尘肺病前期改变,嘱患者尽快脱离粉尘环境,早期行全肺灌洗祛除部分致病颗粒,并加强随访。图1
:(HE×200)局部肺泡腔扩张融合,部分肺泡腔内见较多尘细胞(箭头指示),符合职业相关间质性肺病。(2)病例11:患者男,64岁,有20年装修工职业史,因长期切割瓷砖而接触大量粉尘。主要症状为咳嗽、咳痰,2018年5月30日于我科行TBCB,肺组织标本镜下见尘结节,但其胸部CT无典型尘肺病改变,为进一步明确病因,将肺泡灌洗液送检电镜能谱分析,发现较多可致肺组织致纤维化的含硅物质,经多学科讨论,考虑尘肺病前期改变,嘱患者尽快脱离粉尘环境,早期行全肺灌洗祛除部分致病颗粒,并加强随访。图1 :双肺支气管血管束增多,伴双肺轻度气肿。图1
:双肺支气管血管束增多,伴双肺轻度气肿。图1 :(HE×100)肺组织中均见散在尘肺结节(箭头指示)。
:(HE×100)肺组织中均见散在尘肺结节(箭头指示)。