应用代谢组学法分析3种常用口腔材料对细胞内小分子蛋白的影响
摘要:目的 采用一氢核磁共振(~1H-NMR)的代谢组学方法,分析3种常用口腔材料对细胞的胞内小分子蛋白质谱的影响,探讨代谢组学方法在评价材料生物相容性方面的潜在应用前景。方法 将小鼠成纤维细胞分别与羟基磷灰石-磷酸三钙生物陶瓷、钛合金、聚甲基丙烯酸甲酯(自凝塑料)3种常用口腔材料进行体外培养,并设单独细胞培养作为空白对照。培养72 h后提取细胞内蛋白质,利用核磁共振技术检测细胞内蛋白变化谱,经数据处理和和偏最小二乘法判别分析(PLS-DA),比较各组间小分子蛋白质谱的变化情况,观察各组间小分子蛋白质谱的差异。结果 3组材料引起的细胞内小分子蛋白质谱明显不同,均有各自聚集趋势,分布区域间有较大的分隔区,且区分明显。结论 代谢组学分析细胞内小分子蛋白质谱可能是一种在分子水平上研究口腔材料生物相容性机制以及评价的有效方法。
关键词:代谢组学; 小分子蛋白质; 羟基磷灰石-磷酸三钙生物陶瓷; 钛合金; 甲基丙烯酸甲酯; 生物相容性;
当前,生物材料及其制品正在迅速发展,而医用生物材料的发展,因其与人体的密切关系而受到国际国内各方面重视。生物材料的生物相容性成为生物材料各种性能中的重要关注点,可以解释为生物材料和人体组织接触后,在材料-组织界面发生一系列相互作用后最终被人体组织所接受的性能[1]。目前对生物材料的生物相容性的评价主要通过细胞学和组织学的方法。体外细胞培养试验作为一种初级快速毒性筛选程序,在牙科和其他医用材料的生物安全性评价中具有十分重要的地位[2],而体外细胞培养试验多数仅采用MTT比色法检测细胞增殖情况[3-5]。这显然已经不能满足当前从根本上提高生物材料研究与应用水平的要求。就生物材料生物相容性机制研究的角度看,必须突破传统的研究方法,应用分子生物学的技术研究生物材料对机体基因结构、转录、翻译和代谢调控的影响,在分子水平上建立评价生物材料生物相容性的技术标准,促使生物材料研究领域焕发新的生机。
代谢组学(metabonomics)是一门通过定性和定量等综合方法,分析生物体系受刺激或扰动后一段时间内所有相对小分子质量代谢产物的变化,从而对生物体系进行动态分析的新技术[6]。本实验拟引进基于一氢核磁共振测定的代谢组学方法,对3种常用口腔材料与L-929细胞体外培养后的细胞内小分子蛋白谱进行分析比较,研究其细胞内小分子蛋白谱的差异,探寻和开拓一种快速、简便、灵敏的材料生物相容性的检测方法。
1 材料和方法
1.1 实验材料与仪器
羟磷灰石-磷酸三钙生物陶瓷(HA-TCP)、钛合金(Ti)(口腔疾病研究国家重点实验室和生物医学材料工程技术研究中心提供)、聚甲基丙烯酸甲酯自凝塑料(PMMA,上海二医张江生物材料有限公司);L-929小鼠成纤维细胞(口腔疾病研究国家重点实验室提供,简称L-929细胞);小牛血清(成都哈里生物工程有限公司)、高糖培养基(Dulbecco's modified eagle medium,DMEM,Thermo公司,美国)。
倒置相差显微镜(Olympus公司,日本)、高速低温离心机(Oouan公司,法国),DRX600磁共振仪(Bruker Biospin Rhein-stetten公司,德国)。
1.2 实验方法
1.2.1 材料处理
将3种材料统一制备成直径12 mm、厚度10 mm的圆片,自凝塑料圆片经逐级打磨抛光、超声清洗和干燥后,再经紫外线正反2面各照射30 min灭菌备用;钛合金和羟磷灰石-磷酸三钙生物陶瓷圆片经逐级打磨抛光,超声清洗后高温高压消毒,备用。
1.2.2 细胞培养
将L-929细胞复苏后置于含体积分数5%小牛血清的高糖DMEM培养基中,放置于体积分数5%CO2、37℃、饱和湿度的培养箱内培养,传代2~3次后,细胞长到对数生长期,用质量分数0.25%胰蛋白酶消化,消化后的细胞用DMEM培养液重悬,制成单细胞悬液。
1.2.3 材料和L-929共同培养及观察
无菌条件下将待测材料按照顺序放置于6孔板内,培养基预湿24 h后弃原培养基。无菌条件下收集细胞、计数,将2 mL细胞悬液(3.0×105/mL)分别接种6板孔中的材料上,置于37℃、5%CO2培养箱中静置培养。3 d内每天于倒置相差显微镜下观察细胞在材料上及周围的生长情况。
1.2.4 细胞内蛋白的代谢组学样本制备
本实验共设置4组:羟磷灰石-磷酸三钙生物陶瓷组(HA组)、钛合金组(Ti组)、自凝塑料组(M组)和空白组(C组),每组设4个平行样本。于第72 h收集各组细胞,提取细胞内蛋白。各组样本分别取0.04 mL加入重水0.5 mL锁场,并加入四甲基硅烷(Tetramethylsilane,TMS)各0.1 mL作为内标,混匀后将样品移入直径为5 mm的无菌磁共振管中,密封管口,置于-20℃低温冰箱内保存。1H-NMR测定前取样、解冻并保持其在0℃左右。
1.2.5核磁共振图谱的采集
在德国Broker公司核磁共振仪(NMR)上以重水为溶剂,以TMS为内标,获得16个样本的原始自由感应衰减信号(free inductiondecay,FID)。将这些FID信号传导入Mest Re Nova 8.0软件进行相位调整和基线调整,以获得相位满意、对称性较好的1H-NMR图谱。
1.3 数据处理和统计学分析
为了发掘1H-NMR谱中包含的所有代谢物信息,以0.04为间隔将1H-NMR谱图(10~0)划分为等宽的区域,并对各个区域进行自动积分。为了消除水峰引起的谱线差异,将5~4.5区域设为零积分段。为了补偿样本之间的密度差异,将每一张谱的积分值进行归一化处理。将存有积分值的Excel文件导入SIMCA-P vl 1.0软件,进行最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)。
2 结果
2.1 倒置相差显微镜观察结果
由于材料是不透光的,所以无法直接在倒置相差显微镜下观察细胞在材料表面的生长情况,但可见细胞围绕在材料边缘生长,且随时间递增,Ti组及HA组镜下细胞数目逐渐增加,形态良好;M组镜下细胞数目也有所增加,但材料边缘细胞形态较差,大多呈圆形(见图1)。

图1 倒置相差显微镜下观察细胞与材料的接触情况(×10)
2.2 1H-NMR图谱模式识别
4组样本的细胞内小分子蛋白质典型1H-NMR图谱分别见图2。
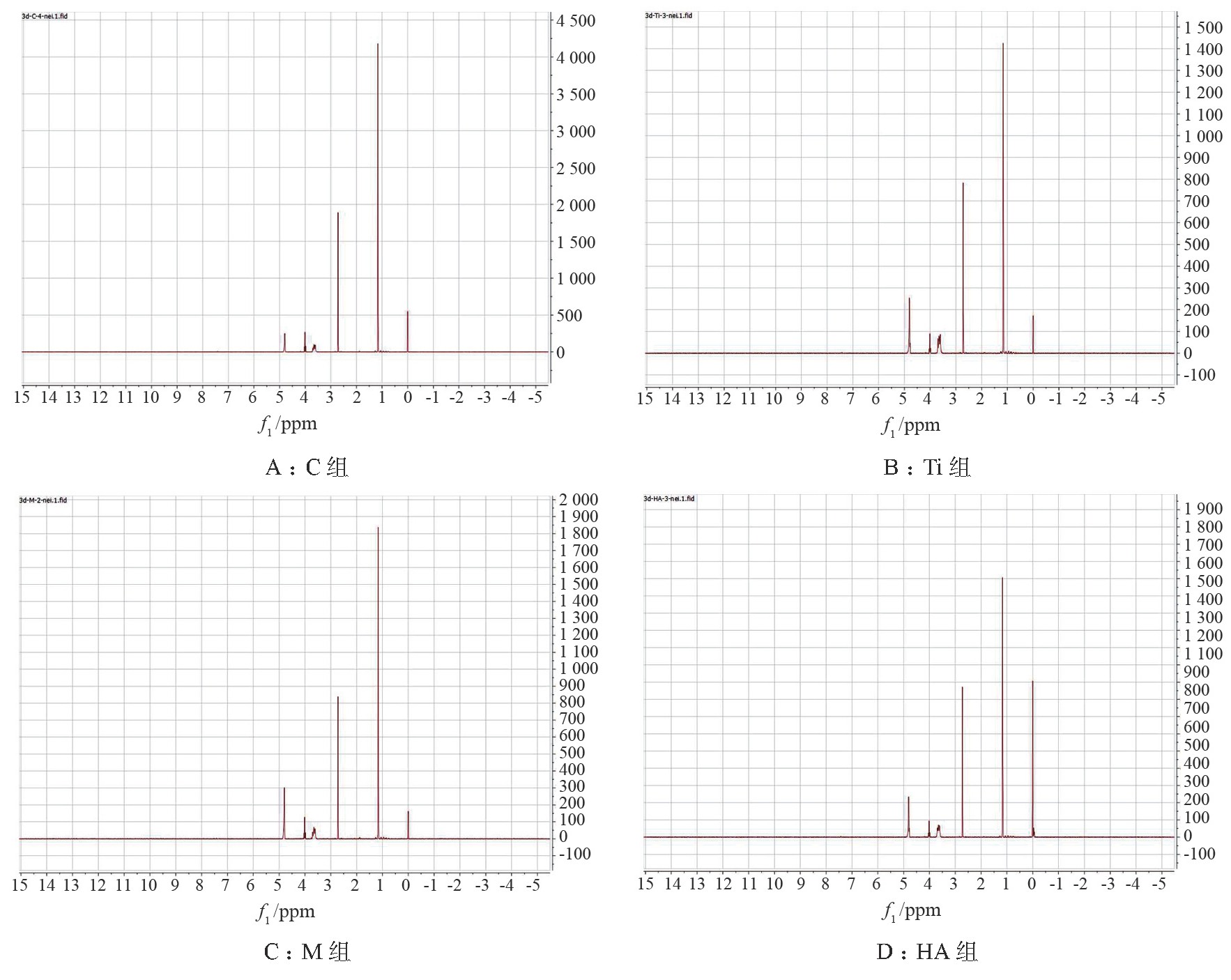 图2 细胞内小分子蛋白质1H-NMR图谱
PLS-DA的分析结果均以第1和第2主成分作为x、y坐标轴构建二维空间的散点图,空间中每一个点代表一个样本见图3。由图3可见主成分积分值集中分布于椭圆形散点图(95%可信区内)的4个区域,各组样本之间无明显交叉和重叠,团聚性较好;可见空白对照组与材料组之间均有差异,其中HA组差异较小,其次为Ti组,M组较大。
图2 细胞内小分子蛋白质1H-NMR图谱
PLS-DA的分析结果均以第1和第2主成分作为x、y坐标轴构建二维空间的散点图,空间中每一个点代表一个样本见图3。由图3可见主成分积分值集中分布于椭圆形散点图(95%可信区内)的4个区域,各组样本之间无明显交叉和重叠,团聚性较好;可见空白对照组与材料组之间均有差异,其中HA组差异较小,其次为Ti组,M组较大。
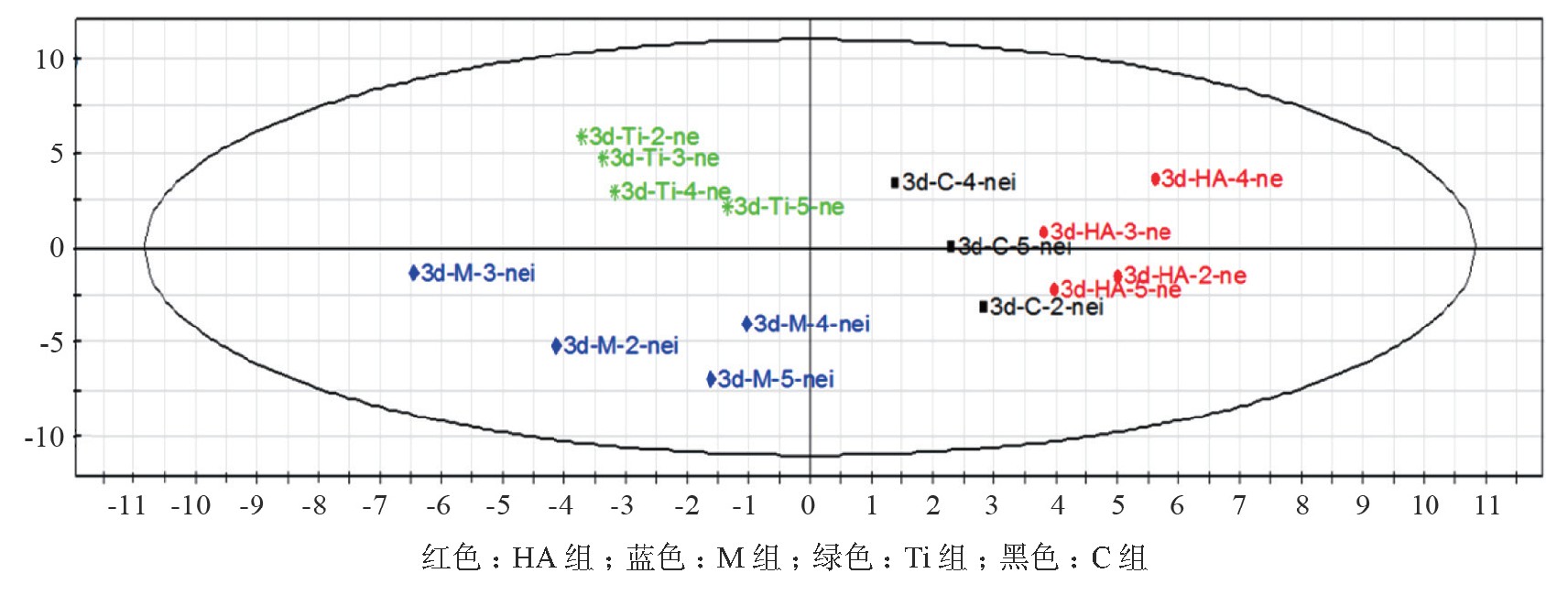 图3 4组样本的PLS-DA得分图
图3 4组样本的PLS-DA得分图
3 讨论
生物相容性一直是口腔材料应用的重要话题,因为其质量的好坏直接影响到患者的口腔健康乃至生命安全。为了确保证口腔材料的安全性,有必要对其进行严格的安全评价,其中非常重要的环节是对口腔材料的生物相容性评价。随着口腔材料的发展与应用,人们逐渐认识到对材料的生物相容性评价需要深入到更精确的水平,而不仅仅是停留在组织学及细胞学的水平。体外实验以其简便易行,可重复性好,易于控制实验条件,可进行定量分析等优点得到广泛应用。近年来羟基磷灰石-磷酸三钙生物陶瓷、钛合金、聚甲基丙烯酸甲酯(自凝塑料)等材料在口腔各个领域的应用广泛,其生物相容性倍受关注。
代谢组学是近20年迅速发展起来的一门较新的组学手段,通过定性和定量等多样化的综合方法分析生物体系受到各种刺激或扰动乃至基因改变后一段时间内所有相对小分子质量代谢产物的动态变化,从而对生物体系进行动态分析的一门科学。它能够提供生物体系统中全部小分子代谢产物的丰富信息,主要通过模式识别和多元统计分析方法对生物体系的体液和组织进行测量分析,并将搜集到的代谢产物信息与各种生理过程中的生物学事件关联起来,用以确定发生相关变化的靶器官及作用的位点,探索可能相关的生物标志物[12]。近年来,代谢组学广泛应用于口腔医学研究的多个方面,主要包括肿瘤标志物的筛选、口腔微生物代谢标志物解析、唇腭裂畸形代谢标志物解析等方面[13-17],但对于口腔材料生物相容性的检测则相对较少。
口腔材料与细胞接触后所引起的相关代谢产物的系列改变在产生细胞毒性或者组织损伤以前就已经发生,因此对生物体分子水平变化的了解益发重要。对各种口腔材料与机体分子间相互作用的深入了解,是口腔材料研发改进的重要参考。
本实验采用体外实验方法,用基于1H-NMR的代谢组学方法检测细胞内小分子蛋白谱的变化,分析其生物相容性,灵敏度高,制样简单,可反映出材料和细胞作用后,调控细胞变化的完整情况。
从细胞形态可以看出,L-929细胞在HA-TCP、Ti边缘生长状态良好,细胞形态较好,而PMMA边缘细胞形态较差,大多接近圆形,可见HA-TCP、Ti的生物相容性相对较好,PMMA较差;而代谢组学检测结果显示:3种材料与L-929细胞培养后,细胞内小分子蛋白谱也不尽相同,与阴性对照组均有一定区别。由此可见,细胞形态与细胞内小分子蛋白谱检测结果具有良好一致性。
细胞内小分子蛋白谱的代谢组学检测结果显示出不同口腔材料对相同细胞产生的作用不同,我们可以根据其差异探寻细胞内代谢途径的变化或者基因的改变。因此将代谢组学应用于生物材料的生物相容性判别具有一定价值,但还需要做进一步的研究。
4 结论
目前,口腔材料的生物相容性研究主要采用细胞学和组织学的方法,与这两种方法相比,代谢组学检测在某种程度上反映基因及蛋白的调控功能其作用可能更敏感,更能深入地研究口腔材料与生物体间的交互作用机制。因此,采用代谢组学的方法来评估口腔材料生物相容性,探讨口腔材料和生物体之间交互作用机制,是未来研究口腔材料生物相容性的重要研究方向之一。
参考文献
[1] Pariente JL,Bordenavel,Bareille R,et al.The biocompatibility of catheters and stents used on urology.Prog U rolAp r 1998;8(2):181-187.
[2]吕小迎,薛淼,徐淑卿.一种评价牙科和生物材料细胞毒性的有效方法125 I-UdR-释放法.口腔材料器械杂志,1997,6(1):5-7.
[3] Sushma Kalmodia,Shilpi Goenka,Tapas Laha,et al.Microstructure,mechanical properties,and in vitro biocompatibility of spark plasmasintered hydroxy apatitealuminum oxide-carbon nanotube composite.Materials Science and Engineering C 30(2010)1162-1169.
[4] Hong Jae Lee,Sung Eun Kim,Hyung Woo Choi,et al.The effect of surface-modified nano-hydroxyapatite on bio compatibility of poly(e-caprolactone)/hydroxyapatite nanocomposites.European Polymer Journal 43(2007)1602-1608.
[5]王琳,卜银忠,王金清,等.壳聚糖-酪蛋白磷酸肽修饰钛合金表面的成骨细胞黏附与增殖.中国组织工程研究与临床康复,2011,15(21):3811-3814.
[6] Nicholson JK,Lindon JC,Holmes E.Metabonomics:Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data,Xenohiotic,1999,29(11):1181-1189.
[7] Hollywood K,Brison DR,Goodacre R.Metabolomics:Current technologies and future trends.Proteomics,2006,6(17):4716-4723.
[8]汤京龙,奚廷斐.纳米羟基磷灰石生物安全性的研究现状.中国组织工程研究与临床康复,2007,11(5):936-939.
[9] Johson HJ.Bio compatibility test procedures for materials evaluation in vitroⅠcomparative test system sensitivity.J Biomed Matel Res,1983.17:571-5 86.
[10] Johson HJ.Bio compatibility test procedures for materials evaluation in vitroⅡobjective method of toxicity asessment.J Biomed Mater Res,1985,19:489-508.
[11] Wang QZ,Wu CY,Chen T,et al.Integrating metabolomics into a systems biology framework to exploit metabolic complexity:Strategies and applications in microorganisms.Appl Microbiol Biotechnol,2006,70(2):151-161.
[12]李姣,周京琳,丁一.代谢组学在口腔医学领域的研究进展.牙体牙髓牙周病学杂志,2014,24(5):300-304.
[13]王辉,赵志华,徐国权,等.耐药口腔鳞癌Tca8113胞外代谢产物的代谢组学分析.第三军医大学学报,2016,38(4):3 96-400.
[14]薛佳艺,孙艳,危常磊,等.口腔鳞状细胞癌病人唾液的代谢组学研究.精准医学杂志,2018,33(2):134-137.
[15]宋颖,周京琳,何远丽,等.sortase A与变异链球菌致龋性关系的代谢组学研究.华西口腔医学杂志,2018,36(4):360-366.
[16]王世林,余子敬,何苇.地塞米松诱导小鼠腭裂的母体血浆代谢组学分析.口腔医学研究,2018,34(5):485-489.
[17] Jinglin Zhou,Huimin Hu,Renhuan Huang.A pilot study of the metabolomic profiles of saliva from female orthodontic patients with external apical root resorption Clinica Chimica Acta,2018,478:188-193.


