牛黄对治疗脑梗死的调控网络和潜在机制研究
摘 要:目的 运用网络药理学的方法预测牛黄治疗脑梗死的潜在靶点,探讨其调控网络及作用机制。方法 通过中药系统药理学数据库与分析平台(TCMSP)数据库和文献挖掘获取牛黄的主要活性成分,利用人类基因数据库GeneCards预测和筛选牛黄活性成分的作用靶点。采用String数据库和Cytoscape 3.7.1软件绘制蛋白相互作用(PPI)网络,借助DAVID6.8数据库进行潜在基因的基因本体论(GO)分析。结果 筛选得到牛黄5个活性成分,涉及3个作用靶点。GO分析结果显示,牛黄治疗脑梗死的生物过程主要涉及类固醇激素受体活性、核受体活性、转录因子活性、类固醇结合、维生素D受体结合、核受体结合、染色质DNA结合、ATP酶结合等。结论 牛黄治疗脑梗死是一个多成分、多靶点的复杂过程,主要通过调控NR3C2、PGR、RXRA这3个靶点,涉及核受体活性、转录因子活性、类固醇结合、维生素D受体结合、染色质DNA结合、ATP酶结合等生物过程而发挥干预脑梗死的作用。
关键词:网络药理学 牛黄 脑梗死 潜在机制
脑梗死是指各种原因引起脑部血液循环障碍,缺血、缺氧所致的局限性脑组织的缺血性坏死或软化,而出现相应的神经系统功能缺损,又称缺血性脑卒中[1],是临床上常见的一种心脑血管疾病,具有发病急骤,致死、致残率高等特点[2]。脑梗死超过48 h病情逐渐恶化、加重,称为进展性脑梗死(progressive cerebral infarction,PCI)[3]。目前临床主要是采取常规药物治疗,包括抗凝、溶栓、抗血小板等,但对患者神经功能恢复难以取得较为理想的效果。脑梗死属于中医学“中风”范畴,其发病常与风、火、痰、虚、瘀等因素相关。“中风”为本虚标实、上盛下虚之证,虽有本虚,但标实更为突出,应以“急则治其标”为原则,分别以平肝熄风、清热涤痰、化痰通腑、活血通络、醒神开窍等法。目前,中医药在治疗脑梗死取得良好的效果,显示了广阔的前景。有文献报道,安宫牛黄丸、体外培育牛黄等牛黄制剂具有明显改善脑缺血症状,减轻脑损伤的作用[4-5]。据文献显示,牛黄有清心解毒、豁痰开窍功能,能调节中枢神经介质儿茶酚胺的活性,从而恢复脑干网状结构上功能,达到醒神复苏的作用[6]。牛黄(Calculus Bovis)是我国传统名贵中药,又名“土精”“丑宝”,最早载于《神农本草经》,列为上品,距今已有两千多年历史[7]。牛黄天然来源于哺乳纲偶蹄目牛科脊椎动物牛的胆囊、胆管以及肝管中的结石,其性凉、味苦,具有清热解毒、熄风止痉、化痰开窍的功效。牛黄在治疗热病神昏、中风痰迷等方面均有较好的效果,但其潜在机制不明确,因此借助网络药理学的方法筛选牛黄的活性成分,挖掘牛黄干预脑梗死的作用靶点以阐明其作用机制,为临床应用提供重要的理论依据。
1 资料与方法
1.1 牛黄活性成分的获取和筛选
中药系统药理学数据库与分析平台(TCMSP)(http://lsp.nwsuaf.edu.cn/tcmsp.php)可以从整体水平研究药物靶标网络和疾病网络,为揭示中药性质与作用机制的平台[8]。从TCMSP数据库获取牛黄的化学成分,输入关键词“牛黄”,得到活性成分信息。口服给药是中药制剂最常见的给药途径[9],口服生物利用度(OB)是评价中药临床药效的有效指标,是药物吸收、分布、代谢、排泄的关键指标之一,也是决定活性组分类药性的关键指标。类药性(DL)>0.18的化合物被认为是具有较高的DL并选为候选分子进行研究[10]。因此本研究通过OB和DL两个指标对牛黄活性成分进行筛选,以OB>30%和DL>0.18[11]为限定条件,在TCM-SP中筛选出符合上述2个条件的成分为牛黄活性较高的的化学成分。
1.2 预测潜在靶点
从TCMSP数据库中检索出牛黄活性成分的作用靶点,作为候选药物的作用靶点。然后通过Uniprot数据库(http://www.uniprot.org/)将候选药物靶点转换成基因名称。以“cerebral infarction”为关键词,通过GeneCards数据库(https://www.genecards.org/)搜索与脑梗死相关的基因。将挖掘到的cerebral infarction相关基因与药物的靶点基因映射筛选得出共同基因,从而得到牛黄活性成分治疗脑梗死的相关作用靶标。
1.3 活性成分-疾病靶点构建
将候选化学成分与cerebral infarction靶点通过Cytoscape 3.7.1建立牛黄的化合物-脑梗死靶点群网络,每个节点(node)是基因、蛋白质或分子;节点与节点之间的连线(edge)代表着这些生物分子之间的相互作用,根据化合物与靶点连接情况筛选出牛黄作用脑梗死的关键化合物。
1.4 蛋白相互作用(PPI)网络构建
将药物活性成分-疾病的交集靶点导入String数据库(https://string-db.org/),以构建牛黄治疗脑梗死PPI网络[12]。限定物种为“homo sapiens”(人类),设定最低相互作用阈值为中等置信度0.4“medium confidence”,其余参数保持不变,得到蛋白相互作用关系,结果保存为TSV格式。使用Cytoscape 3.7.1软件将活性成分-靶点网络与脑梗死相关靶点相互作用网络融合,取交集部分,获得最终的蛋白相互作用网络。
1.5 基因本体论(gene ontology,GO)功能分析
GO是用于描述基因产物功能并且广泛应用于生物信息学领域的一个本体[13]。将药物-疾病交集基因导入DAVID6.8数据库[14],输入靶基因名称列表,限定物种为“homo sapiens”,将靶点基因修正为官方名称(“official gene symbol”),设定阈值P<0.05,进行GO生物过程富集分析,结果用R语言分析作图。
2 结果
2.1 牛黄活性成分及靶点的筛选
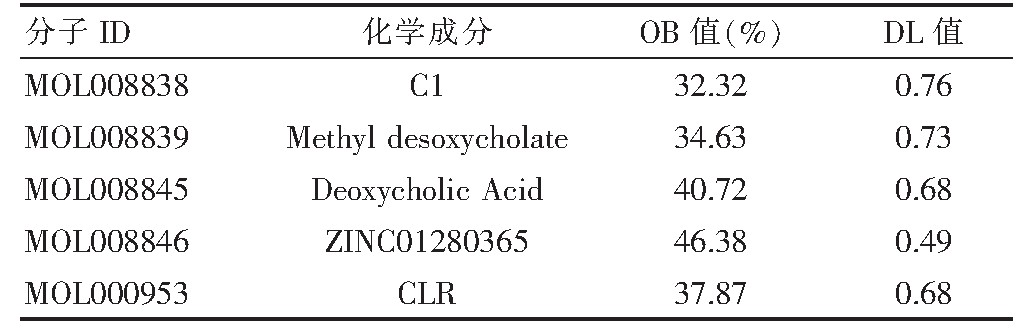
TCMSP中以OB%>30,DL>0.18为筛选条件获得5个牛黄活性成分,结果见表1。逐一对应靶点,得到牛黄活性成分靶点133个。
表1 牛黄候选化合物成分
2.2 疾病潜在靶点获取结果
从GeneCards数据库中检索到2611个脑梗死相关靶点基因。
2.3 网络构建与分析结果
将牛黄活性成分对应靶点与脑梗死相关作用靶点取交集得到活性成分-疾病靶点基因3个,对应牛黄5个活性成分。利用Cytoscape 3.7.1软件构建中药化合物-靶点相互作用网络,具体见图1(封三)。
2.4 PPI网络的构建及关键靶点筛选
将映射得到的靶点基因输入String数据库中进行PPI网络分析,得到蛋白相互作用网络图,如图2(封三)所示。PPI网络包括了3个靶蛋白节点,共有3条边代表了蛋白之间的相互作用,处于该蛋白质-蛋白质相互作用网络中心的蛋白质有NR3C2、PGR、RXRA,可能是牛黄干预脑梗死的重要靶点。
2.5 GO功能分析
3个药物活性成分-疾病交集基因影响了19个生物学过程(P<0.05)(表2、图3,封三)。结果显示,牛黄的活性成分主要富集在类固醇激素受体活性、核受体活性、转录因子活性、类固醇结合、RNA聚合酶Ⅱ近端启动子序列特异性DNA结合、近端启动子序列特异性DNA结合、维生素D受体结合、类维生素A结合、类异戊二烯结合、一元羧酸结合、染色质DNA结合、ATP酶结合等方面。
表2 药物-疾病交集基因具有的功能信息

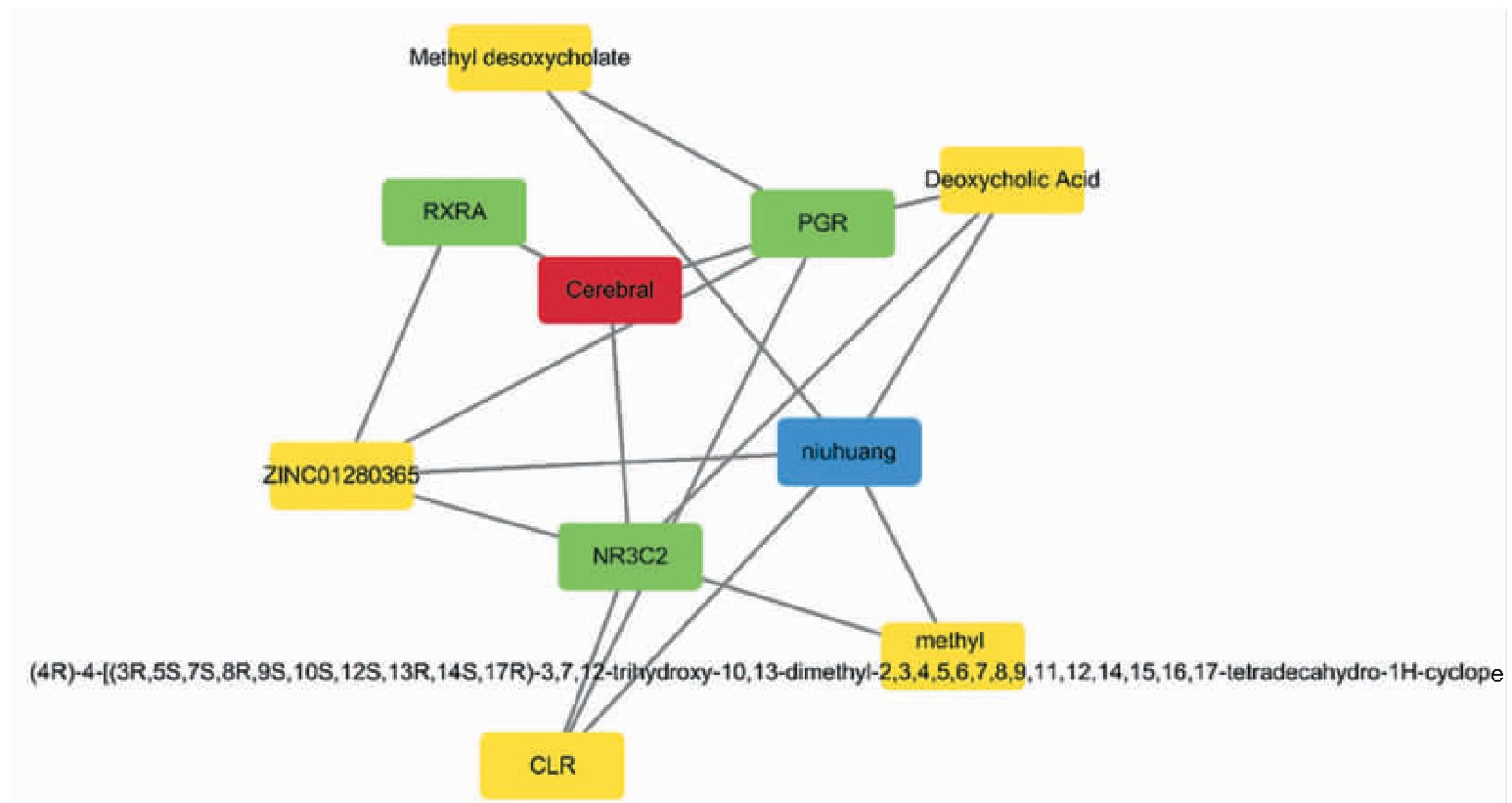 图1 药物有效成分-靶点网络图(见内文第10页)
绿色为活性成分-疾病交集基因;黄色为药物活性成分
图1 药物有效成分-靶点网络图(见内文第10页)
绿色为活性成分-疾病交集基因;黄色为药物活性成分
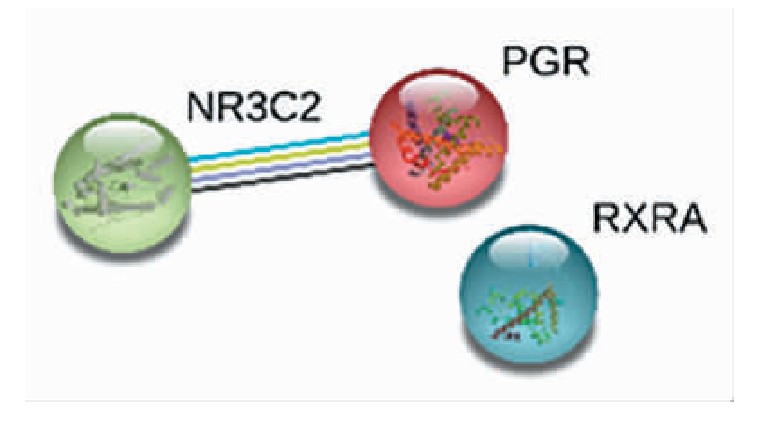 图2 牛黄治疗脑梗死PPI网络图(见内文第10页)
图2 牛黄治疗脑梗死PPI网络图(见内文第10页)
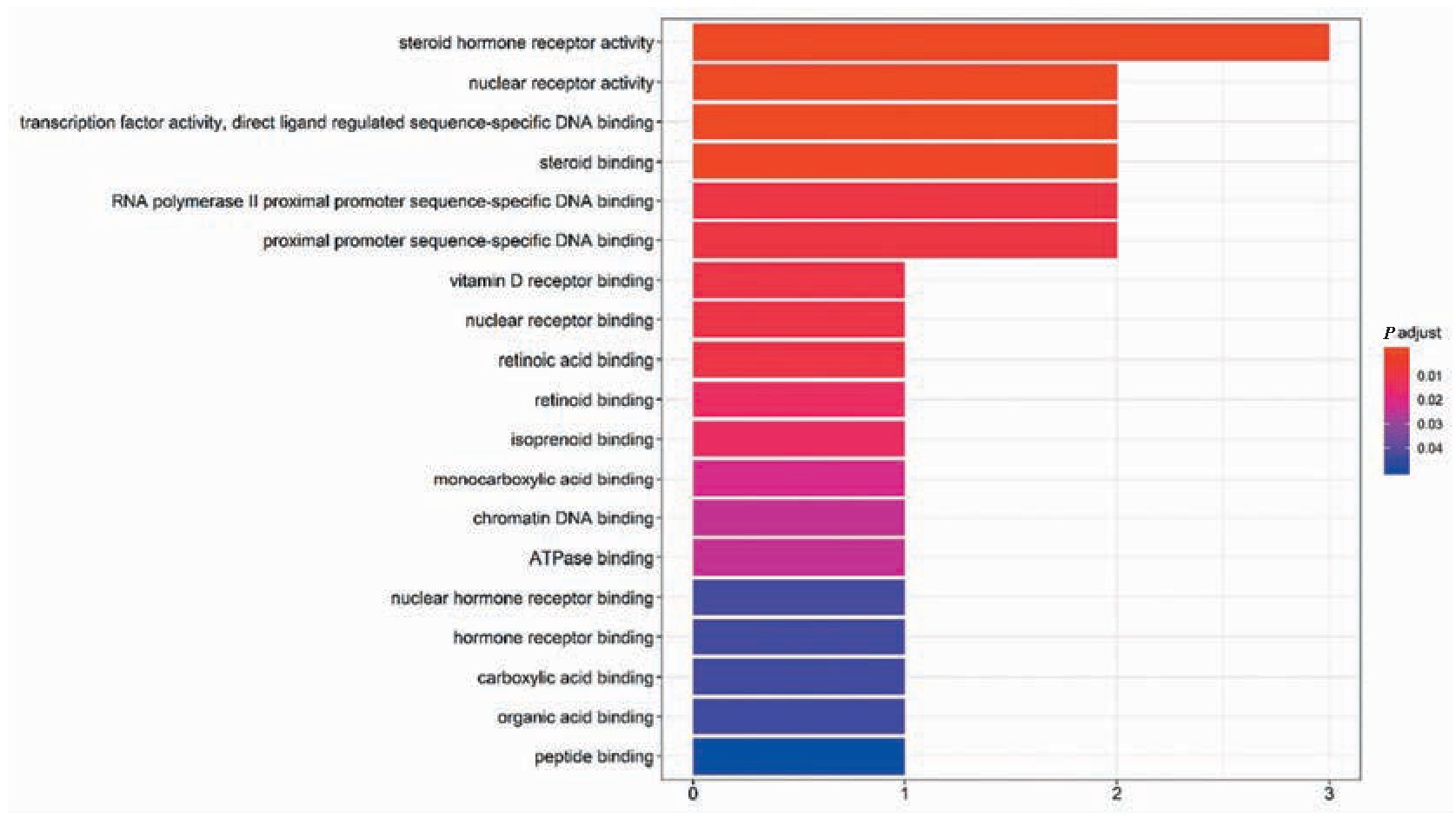 图3 GO功能富集分析柱状图(见内文第10页)
图3 GO功能富集分析柱状图(见内文第10页)
3 讨论
网络药理学是融合系统生物学、多向药理学、计算生物学及网络分析等多学科的技术和内容,进行“疾病-基因-药物”的网络构建,从整体的角度去探讨药物与疾病的相关性,因此本研究借助网络药理学的方法,对牛黄干预脑梗死的潜在作用机制进行探讨。本次研究收集到与牛黄干预脑梗死的相关活性成分有脱氧胆酸甲酯(Methyl desoxycholate)、Deoxycholic Acid、ZINC01280365、CLR等。利用GeneCards数据库得到2611个脑梗死的相关靶点,通过映射找到了NR3C2、PGR、RXRA这3个牛黄干预脑梗死的潜在治疗靶点。同时利用String数据库进行靶蛋白相互作用网络分析,发现这些靶蛋白之间存在着相互联系,由此推测靶点之间的相互调节可能是牛黄治疗脑梗死的潜在机制。进一步提炼牛黄干预脑梗死的生物学过程,发现其靶点主要富集在类固醇激素受体活性、核受体活性、转录因子活性、类固醇结合、维生素D受体结合、核受体结合、染色质DNA结合、ATP酶结合等生物学过程,这与脑梗死的发生发展有一定的联系。
有研究表明,Na+-K+-ATP酶活性对神经元损伤起到关键的作用[15],Na+-K+-ATP酶活性的降低会加重脑组织水肿程度,诱发神经元凋亡,最终导致脑梗死面积扩大,从而影响神经功能的恢复[16]。因此,从本次GO功能分析研究结果推测牛黄的活性成分可能通过保护并提高ATP酶结合活性,以减轻脑水肿和减少神经元凋亡,从而起到干预脑梗死的作用。目前,牛黄活性成分通过何种途径增加Na+-K+-ATP酶活性尚不明确,还需要进一步的研究探讨。另有研究显示,维生素D水平低下与脑梗死发病、进展以及不良预后发生率有密切的相关性[17-18]。亦有研究表明,维生素D可通过多种途径对神经细胞起到保护作用,主要能释放神经营养因子以及免疫调节减弱炎症反应来保护神经[19],亦可抑制PAI-1等凝血因子来抑制血栓形成,改善脑梗死的严重程度,避免神经功能进一步损伤[20]。由此推测在其参与的生物功能过程中,牛黄活性成分可能通过干预维生素D受体结合活性,起到神经保护和抗氧化效应的作用,从而干预脑梗死的发生发展。
综上所述,通过成分、靶点、生物过程的作用网络分析,发现牛黄的作用也是多靶点多途径的过程,说明牛黄作用机体不是单一的,有可能是复杂、系统的作用,符合脑梗死病理生理复杂的发展过程,但由于数据库信息不完全,有些化合物可能会被忽略,一些活性成分可能会在筛选过程中被遗漏,关键基因的提取也是基于一定的算法,有一定的局限性,筛选出的关键基因以及具有预测作用的基因均需要进一步试验验证。
参考文献
[1]常虹.脑梗死的治疗现状及进展分析[J].继续医学教育,2019,33(1):55-57.
[2]Gold AB,Herrmann N,Lanctot KL.Lithium and its Neuroprotective and Neurotrophic Effects:Potential Treatment for Post-Ischemic Stroke Sequelae[J].Curr Drug Targets,2011,12(2):243-255.
[3]王维治.神经病学[M].2版.北京:人民卫生出版社,2013:918.
[4]刘晓明,高善语.安宫牛黄制剂治疗老年急性脑梗死的临床观察[J].光明中医,2016,31(17):2462-2465.
[5]刘晓燕,彭凯润,杨红军,等.体外培育牛黄治疗急性脑梗死临床疗效观察[J].中国中医药信息杂志,2010,17(5):66-67.
[6]许再玲.安宫牛黄丸和肝安治疗重型极重型流行性乙型脑炎80例[J].浙江中医杂志,1995,(7):302-303.
[7]柯荣勋.牛黄及其伪品的鉴别[J].江西中医药,2007,38(11):57-58.
[8]汝锦龙.中药系统药理学数据库和分析平台的构建和应用[D].咸阳:西北农林科技大学,2015.
[9]李明玥,倪健,尹兴斌.改善中药口服生物利用度的制剂技术研究进展[J].中华中医药学刊,2016,34(2):307-311.
[10]刘惠.基于系统药理学的甘草作用机制和新药发现研究[D].咸阳:西北农林科技大学,2013.
[11]Li J,Zhao P,Li Y,et al.Systems pharmacology-based dissection of mechanisms of Chinese medicinal formula Bufei Yishen as an effective treatment for chronicobstructive pulmonary disease[J].Sci Rep,2015,5:15 290.
[12]Von Mering C,Jensen LJ,Snel B,et al.STRING:known and predicted protein-protein associations,integrated and transferred across organisms[J].Nucleic Acids Res,2005,33(Database issue):D433-D437.
[13]Martucci D,Masseroli M,Pinciroli F.Gene ontology application to genomic functional annotation,statistical analysis and knowledge mining[J].Stud Health Technol Inform,2004,102:108-131.
[14]Huang DW,Sherman BT,Lempicki RA.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nat Protoc,2009,4(1):44-57.
[15]Pierre SV,Yang C,Yuan Z,et al.Ouabain triggers preconditioning through activation of the Na+,K+-ATPase signaling cascade in rat hearts[J].Cardiovasc Res,2007,73(3):488-496.
[16]蔺心敬,张丽香,罗永坚,等.Na+-K+-ATP酶活性与缺血半暗带脑组织缺血再灌注损伤的研究[J].中华老年心脑血管病杂志,2013,15(3):302-304.
[17]Kojima G,Bell C,Abbott RD,et al.Low Dietary Vitamin D Predicts 34-Year Incident Stroke The Honolulu Heart Program[J].Stroke,2012,43(8):2163-2167.
[18]Sun Q,Pan A,Hu FB,et al.25-hydroxyvitamin D levels and risk of stroke:A prospective study and meta-analysis[J].Stroke,2012,43(6):1470-1477.
[19]Cui X,Gooch H,Petty A,et al.Vitamin D and the brain:Genomicand non-genomic actions[J].Mol Cell Endocrinol,2017,453(5):131-143.
[20]Jorde R,Sneve M,Torjesen P,et al.Parameters of the thrombogram are associated with serum 25-hydroxyvitamin D levels at baseline,but notaffected during supplementation with vitamin D[J].Thromb Res,2010,125(5):e210-e213.




